山西省运城市芮城县2018-2019学年高一上学期化学期末考试试卷
试卷更新日期:2019-12-18 类型:期末考试
一、单选题
-
1. 化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是( )A、常温下可用铁或铝制容器盛装浓硫酸 B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 C、实验室可用石英坩埚熔融烧碱 D、氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚2. 下列实验操作中错误的是( )A、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 B、蒸发操作时,不能使蒸发皿中的水分完全蒸干后才停止加热 C、容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 D、分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出3. 设NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,22.4 L H2O含有的原子数为3 NA B、常温常压下,1.06 g Na2CO3含有的Na+数目为0.02 NA C、5.6g铁粉放入足量稀硫酸中转移的电子数为0.3NA D、0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为NA4. 下列各组离子,能在溶液中大量共存的是:( )A、Ca2+、Mg2+、Cl-、NO3- B、Al3+、K+、SO42-、OH- C、Fe2+、H+、SO42-、NO3- D、Na+、H+、HCO3-、SO42-5. 下列离子方程式中书写正确的是( )A、向FeCl2溶液中通入Cl2:Fe2+ + Cl2 = Fe3+ + 2Cl- B、Ba(OH)2溶液与硫酸的反应:OH- + H+ = H2O C、碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH- = CO32-+H2O D、将铁粉与水蒸气共热:2Fe+3H2O(g) Fe2O3+3H26. 归纳与推理在化学学习与研究中经常被采用,以下推理正确的是( )A、因为SO2能使酸性KMnO4溶液褪色,所以SO2具有漂白性 B、因为CO2的水溶液可以导电,所以CO2是电解质 C、因为NO2可以与水反应生成硝酸,所以NO2是酸性氧化物 D、因为Na可以与水反应放出H2 , 所以K也可以与水反应放出H27. 氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )A、该反应中NH3被还原 B、该反应利用了Cl2的强氧化性 C、若管道漏气遇氨就会产生白烟 D、生成1mol N2有6mol电子转移8. 水是生命之源,下列有关“水”说法中正确的是( )A、双氧水被称为绿色氧化剂,是因为其还原产物为O2 , 对环境没有污染 B、王水是浓盐酸和浓硝酸按体积比1︰3配成的混合物,可以溶解Au、Pt C、人们利用臭氧的强氧化性可将其用作自来水的消毒剂 D、酸雨是指pH﹤7的雨水9. 如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图像的是:( )
 A、向硫酸溶液中加入氢氧化钡溶液 B、向碳酸氢钠溶液中加入氯化钙 C、向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 D、向氯化铝溶液中加入过量氢氧化钠溶液10. 下列实验“操作和现象”与“结论”对应关系正确的是( )
A、向硫酸溶液中加入氢氧化钡溶液 B、向碳酸氢钠溶液中加入氯化钙 C、向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 D、向氯化铝溶液中加入过量氢氧化钠溶液10. 下列实验“操作和现象”与“结论”对应关系正确的是( )实验操作及现象
实验结沦
A
向酸性KMnO4溶液中滴加H2O2溶液,紫色消失
H2O2具有氧化性
B
氯气通入品红溶液中,溶液褪色
氯气具有漂白性
C
将NaOH浓溶液滴加到饱和FeCl3溶液中呈红褐色
制Fe(OH)3胶体
D
向某溶液加入NaOH并微热,产生能够使湿润的红色,石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A、A B、B C、C D、D11. 下列方法中,不能用于实验室制取氨的是( )A、加热试管中的氯化铵固体 B、在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热 C、将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 D、将烧瓶中的浓氨水加热12. 已知 Cu2S+2Cu2O 6Cu+SO2↑,下列说法正确的是( )A、该反应中的氧化剂只有Cu2O B、Cu2O在反应中既是氧化剂又是还原剂 C、Cu既是氧化产物又是还原产物 D、氧化产物与还原产物的物质的量之比为1:613. 下列物质不能通过化合反应制取的是( )A、NO B、FeSO4 C、H2SiO3 D、SO314. 关于硅及其化合物的叙述中,正确的是( )A、硅是良好的半导体材料,且是制造光缆的主要材料 B、玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 C、工业用焦炭还原二氧化硅生产硅:SiO2+C Si + CO2↑ D、SiO2是酸性氧化物,在一定条件下能和氧化钙反应15. 如图,锥形瓶内盛有气体X,滴管内盛有液体Y。若挤 压胶头滴管的胶头,使液体滴入瓶中,振荡,套在玻璃管一端的小气球慢慢鼓起,则气体X和液体Y不可能是( ) A、X是Cl2 , Y是NaOH溶液 B、X是SO2 , Y是澄清石灰水 C、X是NO,Y是水 D、X是NH3 , Y是氯化钠溶液16. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A、X是Cl2 , Y是NaOH溶液 B、X是SO2 , Y是澄清石灰水 C、X是NO,Y是水 D、X是NH3 , Y是氯化钠溶液16. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验
现象
结论
A
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B
将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
向蔗糖中加入浓硫酸
蔗糖变黑,并放出刺激性气味的气体
浓硫酸具有脱水性和强氧化性
D
将铜片放入浓硫酸中
无明显现象
铜片发生了钝化
A、A B、B C、C D、D17. 某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3- , 已知其中Na+、K+、Ca2+、NO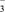 的浓度均为0.1 mol·L-1 , 则Cl-的物质的量浓度为( ) A、0.1mol·L-1 B、0.3mol·L-1 C、0.2mol·L-1 D、0.4mol·L-118. 15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为( )A、4 mol·L-1 B、3 mol·L-1 C、2 mol·L-1 D、1mol·L-1
的浓度均为0.1 mol·L-1 , 则Cl-的物质的量浓度为( ) A、0.1mol·L-1 B、0.3mol·L-1 C、0.2mol·L-1 D、0.4mol·L-118. 15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为( )A、4 mol·L-1 B、3 mol·L-1 C、2 mol·L-1 D、1mol·L-1二、填空题
-
19. 化学知识与我们日常生活密切相关,根据所学知识回答下列问题:(1)、洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。写出工业制漂白粉化学方程式。漂白粉的主要成分是(填化学式)。漂白粉必须密封保存,是由于漂白粉中的有效成分能与空气中的二氧化碳和水蒸气发生反应而使其失效,写出该反应化学方程式。(2)、“84”消毒液(含NaClO)在日常生活中使用广泛,有漂白作用;洁厕灵(主要成分为盐酸)常用作清洗剂,但若将二者混合使用则会使人发生中毒现象。写出二者反应的离子方程式。(3)、侯德榜是我国制碱工业的先驱,为纯碱和氮肥工业技术的发展做出了杰出的贡献。 该制碱工业的关键环节是用氨气、水、二氧化碳和氯化钠反应得到了碳酸氢钠和铵盐,反应的化学方程式为。
三、实验题
-
20. 已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BCl3),生成的三氯化硼遇水水解产生白雾(已知:BCl3的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。

回答下列问题:
(1)、写出装置A中发生反应的离子方程式。(2)、写出装置D中发生反应的化学方程式为。(3)、装置B、E的作用分别是、。(4)、可以用盛装(填试剂名称)的干燥管代替装置F和G,使实验更简便。(5)、为了顺利完成实验,点燃酒精灯的正确操作是(填字母),a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是。
四、推断题
-
21. 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中 使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
 (1)、物质A的化学式为 , F化学式为 ;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为;(4)、A和水反应生成B和C的化学方程式为(5)、印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式。
(1)、物质A的化学式为 , F化学式为 ;(2)、B和R在溶液中反应生成F的离子方程式为;(3)、H在潮湿空气中变成M的实验现象是 , 化学方程式为;(4)、A和水反应生成B和C的化学方程式为(5)、印刷行业刻制印刷电路板(含有铜箔)时,要用W溶液中作为“腐蚀液”,写出该反应的离子方程式。五、计算题
-
22. 将1.66 g碳酸钠和氢氧化钠的固体混合物完全溶于水配成稀溶液,然后向该溶液中逐滴加入1 mo1·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。

请回答下列问题:
(1)、OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有(填化学式)。(2)、当到达B点时,产生CO2的体积为 mL(标准状况)。(3)、计算原混合物中Na2CO3的质量分数。(写出必要计算过程,结果保留3位有效数字)
-
-
-