2019-2020学年华师大版科学九年级上学期期末模拟试卷
试卷更新日期:2019-12-17 类型:期末考试
一、单选题
-
1. 质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )A、
 B、
B、 C、
C、 D、
D、 2. 下列反应的化学方程式书写完全正确的是( )A、石灰浆抹墙变硬CO2+Ca(OH)2=CaCO3+H2O B、含氢氧化铝的药物治疗胃酸过多2Al(OH)3+3HCl=2AlCl3+3H2O C、用纯碱制氢氧化钠Na2CO3+Ca(OH)2=CaCO3↓+2NaOH D、将铁片投入足量的稀硫酸中2Fe+3H2SO4=Fe2(SO4)3+3H2↑3. 关于内能下列说法正确的是( )
2. 下列反应的化学方程式书写完全正确的是( )A、石灰浆抹墙变硬CO2+Ca(OH)2=CaCO3+H2O B、含氢氧化铝的药物治疗胃酸过多2Al(OH)3+3HCl=2AlCl3+3H2O C、用纯碱制氢氧化钠Na2CO3+Ca(OH)2=CaCO3↓+2NaOH D、将铁片投入足量的稀硫酸中2Fe+3H2SO4=Fe2(SO4)3+3H2↑3. 关于内能下列说法正确的是( )
A、物体运动速度越大,分子动能越大,因此内能越大 B、内能跟温度有关,所以0℃的冰没有内能 C、温度高的物体一定比温度低的物体内能大 D、静止的物体没有动能,但具有内能4. 下列对露置在空气中已变质的氢氧化钠溶液样品进行的相关实验中,实验现象及结论合理的是( )A、取少量溶液样品,滴入氯化钡溶液,有白色沉淀生成 B、取一定量溶液样品,滴入稀盐酸,立即有大量气体产生 C、取一定量溶液样品,滴入适量的澄清石灰水,过滤,向滤液中滴加酚酞溶液,溶液变红,证明原样品中含有氢氧化钠 D、向溶液样品中加入过量的澄清石灰水至充分反应, 过滤,可除去样品中的杂质5. 宋代著名的医学家宋慈编写的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理之一是:4Ag+2H2S+O2=2X(黑色)+2H2O下列说法中正确的是( )A、X为Ag2S B、该反应为复分解反应 C、反应中H2S和O2的质量比为17∶16 D、反应前后,银元素、氧元素的化合价均没有改变6. 水的比热容大,这种特性使它在生活和生产中有着十分广泛的应用。下列应用中不属于利用这种特性的是( )A、晚上向秧田里灌水 B、夏天在地上洒水降温 C、汽车发动机用水作为冷却剂 D、冬天让热水流过散热器来取暖7. 用相同的加热装置给质量相等的甲、乙两种液体同时加热,两种液体的温度随t时间的变化如下表所示。由数据比较两种液体的比热容 ( )时间t / min
0
1
2
3
4
5
甲的温度/ ℃
20
22
24
26
28
30
乙的温度/ ℃
20
25
30
35
40
45
A、c甲 > c乙 B、c甲 = c乙 C、c甲 < c乙 D、无法确定8. 如图所示装置,物体B放在水平桌面上,物体A通过滑轮组拉住物体B,此时物体B保持静止。小明用竖直向下大小为2N的力F1拉重为1N物体A时,物体B以0.6m/s的速度水平匀速向右运动;小明只用水平向左的拉力F2拉物体B时,物体A以0.3m/s的速度匀速上升。不计轮重、绳重和轴摩擦,则下列判断正确的是( ) A、物体B受到的滑动摩擦力大小为6N B、水平向左拉物体B时,拉力F2的大小为10N C、水平向左拉物体B时,拉力F2功率为1.2W D、用力F1竖直向下拉物体A时,拉力F1的功率为0.4W9.
A、物体B受到的滑动摩擦力大小为6N B、水平向左拉物体B时,拉力F2的大小为10N C、水平向左拉物体B时,拉力F2功率为1.2W D、用力F1竖直向下拉物体A时,拉力F1的功率为0.4W9.下图为某化工企业生产流程示意图,有关说法正确的是( )
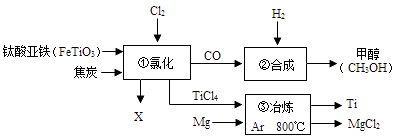 A、③中氩气(Ar)作反应物 B、钛酸亚铁(FeTiO3)中钛元素为+3价 C、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 D、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl310. 继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17.7%的PdCl2溶液100g,加入10.0g铁粉使其充分反应得钯金和铁的氯化物。经分析所得钯金的质量为10.6g,未反应的铁粉质量为4.4g,下列说法正确的是( )A、生成铁的氯化物质量为12.7g B、生成铁的氯化物质量为16.25g C、该反应说明钯金比铁活泼 D、生成铁的氯化物为FeCl311. 有一种新型锂电池,它选用的材料与以往电池不同,主要的反应原理可表示为8Li+3SOCl2 =Li2SO3+6LiCl+2S,相关描述正确的是( )A、Li失去电子形成阳离子 B、S元素的化合价有3种 C、该反应为置换反应 D、生成物Li2SO3为氧化物12. “柴、米、油、盐”是厨房常备用品,其主要成分属于无机物的是( )A、柴(纤维素) B、米(淀粉) C、油(脂肪) D、盐(氯化钠)13. 如图所示杠杆 AOB 能绕 O 点转动(杆重和摩擦均不计),已知 OA=L1 , OB=L2 , F1 与 OA垂直,F2 与 OB 垂直,且 F1L1=F2L2 , 则此杠杆在 F1 和 F2 作用下的状态( )
A、③中氩气(Ar)作反应物 B、钛酸亚铁(FeTiO3)中钛元素为+3价 C、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 D、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl310. 继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17.7%的PdCl2溶液100g,加入10.0g铁粉使其充分反应得钯金和铁的氯化物。经分析所得钯金的质量为10.6g,未反应的铁粉质量为4.4g,下列说法正确的是( )A、生成铁的氯化物质量为12.7g B、生成铁的氯化物质量为16.25g C、该反应说明钯金比铁活泼 D、生成铁的氯化物为FeCl311. 有一种新型锂电池,它选用的材料与以往电池不同,主要的反应原理可表示为8Li+3SOCl2 =Li2SO3+6LiCl+2S,相关描述正确的是( )A、Li失去电子形成阳离子 B、S元素的化合价有3种 C、该反应为置换反应 D、生成物Li2SO3为氧化物12. “柴、米、油、盐”是厨房常备用品,其主要成分属于无机物的是( )A、柴(纤维素) B、米(淀粉) C、油(脂肪) D、盐(氯化钠)13. 如图所示杠杆 AOB 能绕 O 点转动(杆重和摩擦均不计),已知 OA=L1 , OB=L2 , F1 与 OA垂直,F2 与 OB 垂直,且 F1L1=F2L2 , 则此杠杆在 F1 和 F2 作用下的状态( ) A、一定静止 B、一定匀速转动 C、可能静止或匀速转动 D、一定变速转动14. 重为200N的物体,利用轻质滑轮组在拉力F为30N的作用下,以0.2m/s的速度在水平地面上匀速移动了5s。不计轮重、绳重和轴摩擦,则下列判断正确的是( )
A、一定静止 B、一定匀速转动 C、可能静止或匀速转动 D、一定变速转动14. 重为200N的物体,利用轻质滑轮组在拉力F为30N的作用下,以0.2m/s的速度在水平地面上匀速移动了5s。不计轮重、绳重和轴摩擦,则下列判断正确的是( ) A、物体受到的摩擦力为90N B、拉力F做的功为30J C、拉力F的功率为12W D、拉力F做的功等于克服物体重力做的功15. 生活中常用湿润的氯化钯(PdCl2)试纸来检测CO对环境的污染情况。已知CO与PdCl2溶液反应的化学方程式:CO+PdCl2+X=2Hcl+Pd↓十CO2。下列分析错误的是( )A、X为H2O B、从生成物的角度分析,Pd的金属活动性比氢弱 C、反应前后Cl元素的化合价不变 D、反应中Pd2+失去电子变成Pd16.
A、物体受到的摩擦力为90N B、拉力F做的功为30J C、拉力F的功率为12W D、拉力F做的功等于克服物体重力做的功15. 生活中常用湿润的氯化钯(PdCl2)试纸来检测CO对环境的污染情况。已知CO与PdCl2溶液反应的化学方程式:CO+PdCl2+X=2Hcl+Pd↓十CO2。下列分析错误的是( )A、X为H2O B、从生成物的角度分析,Pd的金属活动性比氢弱 C、反应前后Cl元素的化合价不变 D、反应中Pd2+失去电子变成Pd16.如图所示,当滑片P置于中点时,小灯泡比正常发光时暗,当滑片P由中点向a端滑动时,下列说法正确的是(灯泡的电阻随温度变化)
 A、电流表示数变小,小灯泡变亮 B、电压表示数变大,小灯泡变暗 C、电路消耗的总功率不变 D、电压表与电流表示数的比值变大17. 下列各实验现象的分析中,不正确的是( )
A、电流表示数变小,小灯泡变亮 B、电压表示数变大,小灯泡变暗 C、电路消耗的总功率不变 D、电压表与电流表示数的比值变大17. 下列各实验现象的分析中,不正确的是( ) A、甲图中,瓶盖起跳后瓶口出现白雾说明气体对外做功后内能减少、温度下降 B、乙图中,木块被撞击后移动的距离越大说明撞击时铁球具有的动能越大 C、丙图中,滚摆运动到最低点动能为零 D、丁图中,迅速下压活塞,筒内空气温度升高是由于活塞压缩空气做功,空气内能增加
A、甲图中,瓶盖起跳后瓶口出现白雾说明气体对外做功后内能减少、温度下降 B、乙图中,木块被撞击后移动的距离越大说明撞击时铁球具有的动能越大 C、丙图中,滚摆运动到最低点动能为零 D、丁图中,迅速下压活塞,筒内空气温度升高是由于活塞压缩空气做功,空气内能增加二、填空题
-
18. 运用酸、碱、盐的性质可以解决工业生产中的许多问题。(1)、工业上常选用来除去铁锈。(写出一种具体物质)(2)、某工厂向含有 AgNO3、Cu(NO3)2 的废水中加入一定量的锌粉(Zn)以回收金属,充分反应后,得到的金属组成可能有哪几种情况?。
19. 实验室用下图所示装置的部分或全部组合后完成如下实验,请回答下列问题: (1)、小明要证明鸡蛋壳的主要成分是碳酸盐,他将 A 装置中的导气管 a 与 C 装置中的导气管相连,当装置 C 中产生的现象时即达到实验目的。
(1)、小明要证明鸡蛋壳的主要成分是碳酸盐,他将 A 装置中的导气管 a 与 C 装置中的导气管相连,当装置 C 中产生的现象时即达到实验目的。
(2)、若将 A 装置中的药品换成稀硫酸和锌粒,产生的 H2 经干燥后用 D 装置收集,当 D 装置的瓶口向下时,导管口的连接顺序应是 a→b→c→。(3)、B 装置中使用过的浓硫酸稀释后,还可以用作它用,用烧杯稀释浓硫酸时,应后向烧杯中倒入的物质是。20. 根据碱的四条化学性质回答下列问题: (1)、碱溶液能使酚酞溶液变色;(2)、图中的X代表一类物质,则X为(填物质类别),请写出符合性质③的一个化学反应方程式;(3)、碱溶液有相似化学性质的原因是都含有.21.
(1)、碱溶液能使酚酞溶液变色;(2)、图中的X代表一类物质,则X为(填物质类别),请写出符合性质③的一个化学反应方程式;(3)、碱溶液有相似化学性质的原因是都含有.21.如图所示,电源电压保持不变,小灯泡L标有“6V 0.6 W”的字样,R为定值电阻,闭合S1 , 断开S2 , 小灯泡正常发光;若再闭合S2 , 发现电流表示数变化了0.3 A,则R的阻值为Ω,此时灯泡L和电阻R消耗的功率之比是。
 22. 如图所示是一个自制密度秤,其外形和杆秤差不多。装秤钩的地方吊着一个铁块,提纽位于B处,秤砣放在A处时,秤杆恰好水平平衡。把铁块浸没在待测密度的液体中时,移动秤砣便可直接在杆上读出液体的密度。
22. 如图所示是一个自制密度秤,其外形和杆秤差不多。装秤钩的地方吊着一个铁块,提纽位于B处,秤砣放在A处时,秤杆恰好水平平衡。把铁块浸没在待测密度的液体中时,移动秤砣便可直接在杆上读出液体的密度。
(1)、在图示甲位置平衡时,整个装置的总重心位于。(“A处”、“B处”、“AB之间的某一位置”)(2)、若测量酒精的密度时,铁块没有完全浸没,则测量值(“大于”、“等于”、“小于”)真实值。23. 从能量转化的角度看,电源是把其他形式的能转化为电能的装置,如干电池将能转化为电能;用电器则是将电能转化为其他形式能的装置,如电风扇工作时将电能主要转化为能,电热水器将电能转化为能。
24.一个同学家中的电能表,月初示数为
 , 月末示数为
, 月末示数为 , 则这个月该同学消耗的电能为 度,合 J.25. 糖类、油脂、蛋白质和维生素都是人类的基本营养物质.下表为某品牌燕麦片标签中的一部分.
, 则这个月该同学消耗的电能为 度,合 J.25. 糖类、油脂、蛋白质和维生素都是人类的基本营养物质.下表为某品牌燕麦片标签中的一部分.每100g含有
营养成分
糖类
油脂
蛋白质
维生素C
钙
镁
钠
锌
7.6g
7.8g
7.4g
18mg
201mg
18.2mg
30.8mg
8.1mg
麦片的营养成分中能与水反应生成氨基酸的营养物质是;每克营养物质氧化时放出能量最多的是 .
②维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失.因此,烹调富含维生素C的食物时,应该注意;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点
26. 看图回答下列问题: (1)、上述金属制品,利用其导热性的是(填序号),A 图中用到的合成材料是。(2)、铁制水龙头易生锈,写一条能防止铁制品生锈的方法。27. 很多衣服都是由化纤布料制成的,有些化纤布料衣服穿在身上很容易“上灰尘(脏)”,试回答下列问题:(1)、从材料上讲,化纤属于 材料。A、金属材料(合金) B、有机合成材料 C、无机非金属材料(2)、化纤布料易 “上灰尘”主要是由化纤布料易发生从而造成吸引轻小物体的。
(1)、上述金属制品,利用其导热性的是(填序号),A 图中用到的合成材料是。(2)、铁制水龙头易生锈,写一条能防止铁制品生锈的方法。27. 很多衣服都是由化纤布料制成的,有些化纤布料衣服穿在身上很容易“上灰尘(脏)”,试回答下列问题:(1)、从材料上讲,化纤属于 材料。A、金属材料(合金) B、有机合成材料 C、无机非金属材料(2)、化纤布料易 “上灰尘”主要是由化纤布料易发生从而造成吸引轻小物体的。三、实验探究题
-
28. 小丽午餐时买了一份清炒菠菜和一份豆腐肉片汤,但同学告诉她菠菜不能与豆腐同食。
【发现问题】菠菜为什么不能与豆腐同食?
【查阅资料】a.制作豆腐需要加入石膏(主要成分:CaSO4);
b.菠菜中含有草酸、草酸盐等成分;
c.草酸钙是一种既不溶于水也不溶于醋酸的白色固体,是诱发人体结石的物质之一。【提出猜想】菠菜与豆腐同食可能会产生人体不能吸收的沉淀物。
(1)、【设计实验】实验步骤
实验现象
实验结论
①将菠菜在少量开水中煮沸2~3min,取1~2mL滤液于试管中,并滴加少量溶液
产生白色沉淀
有草酸钙生成
②在步骤①的沉淀物中加入过量醋酸
沉淀部分溶解,且产生气泡
被溶解的沉淀一定不是
(2)、【发现新问题】被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:实验步骤
实验现象
实验结论
③将步骤②产生的气体通入 中
产生的气体是 ;步骤②被溶解的沉淀是碳酸钙
(3)、【反思与应用】①家庭中常常将菠菜放在开水中煮沸2~3min捞出后再烹饪,其目的是;
②联想到人体胃液中含有盐酸,请提出一个你想要探究的新问题:。
29. 为了比较不同物质吸收热量的多少跟物质自身的特性有关,小明选取了水和煤油进行实验,并组装了如图所示的装置,将质量和初始温度相同的煤油和水分别装在两个相同的烧杯中,用相同的酒精灯同时开始加热,并适时记录两者的温度(记录结果如下表),试分析。 (1)、实验时为比较水和煤油吸热本领的大小方法有:
(1)、实验时为比较水和煤油吸热本领的大小方法有:方法一:可以在加热时间相同的情况下,比较;
方法二:。
(2)、从表中可得出的结论是:相同质量的水和煤油加热5分钟后,煤油升高的温度高,煤油的比热容比水(选填“大”或“小”)一些;(3)、为了缩短实验时间,使效果更加显著,下列改进措施合理的是。A.将两个烧杯均盖上相同的盖子 B.将装置移到通风良好处进行
C.减少水和煤油的质量
30. 小海要测定标有“2.5V”字样小灯泡的额定功率,选择了一些器材连接如图所示电路(电源用两节新的干电池) (1)、同组的小曙发现小海的电路连接有误,如果此时闭合开关,电压表的示数为 V。请你在接的那根导线上打“×”,并另画一根导线,使电路连接正确。(2)、改正错误后,小海正确操作实验,测量数据如下表所示:
(1)、同组的小曙发现小海的电路连接有误,如果此时闭合开关,电压表的示数为 V。请你在接的那根导线上打“×”,并另画一根导线,使电路连接正确。(2)、改正错误后,小海正确操作实验,测量数据如下表所示:实验次数
1
2
3
4
5
6
7
8
发光情况
明亮
亮
更明亮
较亮
较暗
微光
熄灭
熄灭
电压U/V
2.5
2.1
3.0
1.7
1.3
0.9
0.5
0.1
电流I/A
0.28
0.26
0.30
0.24
0.21
0.19
0.16
0.05
分析实验数据可知:小灯泡在断电一段时间后的电阻可能是(填“0Ω”、“1Ω”、“2Ω”或“8.9Ω”)
31. 生产生活中,我们经常发现存放不当的铁制品,一段时间后就会生锈的现象。如图是某兴趣小组对铁钉生锈的条件进行探究。 (1)、通过观察发现B、C试管中的铁钉都不易生锈,其原因是。(2)、该兴趣小组还发现铁钉生锈需要几天的时间。后查得资料:氯化物可能加快铁钉生锈的速度,为此进行了“氯化物对铁钉生锈有怎样的影响?”的探究实验:
(1)、通过观察发现B、C试管中的铁钉都不易生锈,其原因是。(2)、该兴趣小组还发现铁钉生锈需要几天的时间。后查得资料:氯化物可能加快铁钉生锈的速度,为此进行了“氯化物对铁钉生锈有怎样的影响?”的探究实验:编号
①号试管+铁钉
②号试管+铁钉
③号试管+铁钉
④号试管+铁钉
实验
操作
加6mL蒸馏水
加5mL蒸馏水和1mL1%NaCl溶液
加5mL蒸馏水和1mL1%CaCl2溶液
加5mL蒸馏水和1mL1%CuCl2溶液
现象
3天后,铁钉表面
出现红色物质
1天后,铁钉表面
出现红色物质
1天后,铁钉表面
出现红色物质
10分钟时铁钉表面
出现红色物质
请结合上述实验回答:
I、 对比实验①②③可以得到的结论是 。
II、 小组同学又提出了验证试管④中红色物质组成的实验思路:取红色物质和足量稀硫酸反应,如果观察到 , 则红色物质中既有铁锈,又有铜。
四、解答题
-
32. 小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定。取废液上层清液 50 克,逐滴加入质量分数为 26.5%的碳酸钠溶液,出现气泡,滴加至 10 克开始出现白色沉淀。继续滴加至沉淀不再产生,过滤,测得沉淀的质量为 5 克,并绘制了图象。
 (1)、滴加的溶液中溶质属于(选填“盐”或“碱”);
(1)、滴加的溶液中溶质属于(选填“盐”或“碱”);
(2)、10 克碳酸钠溶液中含有的溶质质量是克;
(3)、图象中的 a 点数值是;
(4)、废液中含有的溶质是(写化学式);(5)、通过计算说明,图象横坐标中的 b 点表示的溶液的质量是多少克?33. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:①取200g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别
一
二
三
四
五
混合溶液质量/g
200
200
200
200
200
铁屑质量/g
6
9
12
15
18
析出铜的质量/g
6.4
9.6
m
16
16
请分析计算:
(1)、表中第三组实验的m值为。(2)、第组实验恰好完全反应。(3)、铁屑中铁的质量分数为多少?(计算结果精确到0.1%)(4)、原混合溶液中FeCl2的质量分数为多少?(计算结果精确到0.1%)34. 用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取 15 克干燥样品进行实验。 (1)、在实验中,乙装置的作用是。
(1)、在实验中,乙装置的作用是。
(2)、准确称取完全反应前后装置丙和丁的质量如下表:装置丙
装置丁
反应前
48.8 克
161.2 克
反应后
46.5 克
163.9 克
小明根据装置丙减少的质量就是氧元素质量,求得氧化铜质量为 11.5 克,纯度为 76.7%。
小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程)。
(3)、比较两种计算结果,请分析导致这一结果的原因可能是( )。A、装置的气密性不好 B、空气中的水分被丁处浓硫酸吸收 C、通入的氢气量不足 D、空气中的二氧化碳被丁处浓硫酸吸收35. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸,已知:NaHCO3+HCl==NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验: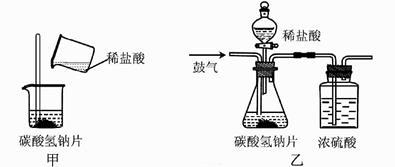 (1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的质量。(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(答出一点即可)。(3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
(1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的质量。(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(答出一点即可)。(3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:实验序号
1
2
3
碳酸氢钠片样品质量/克
3.0
3.0
3.0
反应前总质量/克
193.8
194.6
193.6
反应后总质量/克
192.6
193.6
192.5
二氧化碳质量/克
请计算药片中碳酸氢钠的质量分数。
36. 空调扇具有“送风、加湿和降温”等功能,其内部主要结构为风扇、水箱和空气过滤网等。使用时,通常向水箱中加水,使吹出的风比无水时凉爽。下表是某品牌空调扇部分参数。项目
参数
项目
参数
额定电压
220伏
额定功率
50瓦
空机质量
7.5千克
单个轮子接触地面面积
2厘米2
水箱容量
0.5升
轮子数量
4个
蒸发量
1升/时
电源线长度
1.2米
 (1)、向水箱的水里再加入一些碎冰,可降低水温,使吹出的风比只有水时更凉爽。加冰可降低水温的原因有。(2)、人在运动大量出汗后,对着空调扇吹,很容易感冒。此时,在脑干调节下,皮肤血管收缩,血流量减少,皮肤温度下降,散热量 ,从而维持人体体温恒定。(3)、小科阅读参数表发现,该空调扇比较省电。计算该空调扇正常工作10小时消耗的电能。(4)、计算水箱加满水时该空调扇对水平地面的压强。(5)、该空调扇底座安装了万向轮,方便移动。但在其他设计上仍存在缺陷,为更方便用户使用,请结合表中参数提出一条改进建议: 。37. 寒假里小金和小徐一起玩了一回极速滑雪,如图甲。为研究方便将其简化为模型,如图乙。设小徐和小金及座垫的总质量分划为m和M,他们分别从轨道A点以初速为0向下滑行,求:
(1)、向水箱的水里再加入一些碎冰,可降低水温,使吹出的风比只有水时更凉爽。加冰可降低水温的原因有。(2)、人在运动大量出汗后,对着空调扇吹,很容易感冒。此时,在脑干调节下,皮肤血管收缩,血流量减少,皮肤温度下降,散热量 ,从而维持人体体温恒定。(3)、小科阅读参数表发现,该空调扇比较省电。计算该空调扇正常工作10小时消耗的电能。(4)、计算水箱加满水时该空调扇对水平地面的压强。(5)、该空调扇底座安装了万向轮,方便移动。但在其他设计上仍存在缺陷,为更方便用户使用,请结合表中参数提出一条改进建议: 。37. 寒假里小金和小徐一起玩了一回极速滑雪,如图甲。为研究方便将其简化为模型,如图乙。设小徐和小金及座垫的总质量分划为m和M,他们分别从轨道A点以初速为0向下滑行,求:
 (1)、小金及座垫由A点到达B点时,重力做功为;(2)、若曲线轨道光滑,则小徐和小金由A点到达B点时的速度vm=vM , 请证明之(已知M>m,动能表达式E动=1/2mv2);
(1)、小金及座垫由A点到达B点时,重力做功为;(2)、若曲线轨道光滑,则小徐和小金由A点到达B点时的速度vm=vM , 请证明之(已知M>m,动能表达式E动=1/2mv2);
(3)、若曲线轨道粗糙,小金由A点到达B点时速度刚好为零,座垫材料的比热为C,质量为m0 , 小金在滑动过程中克服摩擦所做的功40%转化为坐垫的内能,则坐垫温度升高多少?