浙江省宁波市奉化市2018-2019学年九年级上学期科学期中四校联考测试卷(1-4)
试卷更新日期:2019-12-11 类型:期中考试
一、选择题(本大题共有15小题,1~10小题,每小题4分,11~15小题,每小题3分,共55分)
-
1. 下列生活用品所含的主要材料,不属于有机物的是 ( )A、不锈钢碗 B、纯棉毛巾 C、羊毛围巾 D、蚕丝被芯2. 下列实验基本操作正确的是 ( )A、氧气验满
 B、浓硫酸稀释
B、浓硫酸稀释  C、气密性检验
C、气密性检验  D、液体加热
D、液体加热  3. 物质的性质与用途密切相关,下列做法不合理的是( )A、工业上用稀盐酸除铁锈 B、农业上用熟石灰改良酸性土壤 C、碳酸钠用于玻璃、造纸、洗涤剂的生产 D、用氢氧化钠治疗胃酸过多4. 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )A、Mn+2HCl =MnC12+H2↑ B、Mg +MnSO4= MgSO4+Mn C、Mn+Cu(NO3)2=Mn(NO3)2+Cu D、Fe+MnSO4 =FeSO4+Mn5. 某种新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,这利用了金属的( )A、延展性 B、导电性 C、弹性 D、导热性6. 分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )A、KCl、NaOH、CuSO4 B、HNO3、NaCl、K2SO4 C、BaCl2、NaOH、H2SO4 D、FeCl3、Na2SO4、KCl7. 镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式La2 O3 , La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是( )A、La2O3和HCl B、La(OH)3和HCl C、NaCl和La(OH)3 D、La和HCl8. “丹砂烧之成水银”中的“丹砂”指的是硫化汞,该反应的微观示意图如下,有关说法正确的是( )
3. 物质的性质与用途密切相关,下列做法不合理的是( )A、工业上用稀盐酸除铁锈 B、农业上用熟石灰改良酸性土壤 C、碳酸钠用于玻璃、造纸、洗涤剂的生产 D、用氢氧化钠治疗胃酸过多4. 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )A、Mn+2HCl =MnC12+H2↑ B、Mg +MnSO4= MgSO4+Mn C、Mn+Cu(NO3)2=Mn(NO3)2+Cu D、Fe+MnSO4 =FeSO4+Mn5. 某种新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线,当玻璃被击碎时,与金属线相连的警报系统就会立刻报警,这利用了金属的( )A、延展性 B、导电性 C、弹性 D、导热性6. 分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )A、KCl、NaOH、CuSO4 B、HNO3、NaCl、K2SO4 C、BaCl2、NaOH、H2SO4 D、FeCl3、Na2SO4、KCl7. 镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式La2 O3 , La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是( )A、La2O3和HCl B、La(OH)3和HCl C、NaCl和La(OH)3 D、La和HCl8. “丹砂烧之成水银”中的“丹砂”指的是硫化汞,该反应的微观示意图如下,有关说法正确的是( ) A、“
A、“ ”代表非金属单质汞
B、此反应遵循质量守恒定律
C、反应前后原子的种类发生改变
D、反应前后各元素的化合价都不变
9. 打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl﹣)。下列实验能证明“白雾”中含有氢离子的是( )
”代表非金属单质汞
B、此反应遵循质量守恒定律
C、反应前后原子的种类发生改变
D、反应前后各元素的化合价都不变
9. 打开浓盐酸试剂瓶,发现瓶口有“白雾”出现。已知盐酸中含有水分子(H2O)、氢离子(H+)和氯离子(Cl﹣)。下列实验能证明“白雾”中含有氢离子的是( ) A、①③ B、②④ C、①②④ D、①③④10. 小明设计了趣味实验装置(见图),其气密性良好。若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( )
A、①③ B、②④ C、①②④ D、①③④10. 小明设计了趣味实验装置(见图),其气密性良好。若要使B中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是( ) A、氯化钠和水 B、硝酸铵和水 C、二氧化锰和过氧化氢溶液 D、铜和稀硫酸11. 为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )
A、氯化钠和水 B、硝酸铵和水 C、二氧化锰和过氧化氢溶液 D、铜和稀硫酸11. 为除去下列物质中的杂质(括号内是杂质),下列操作方法正确的是( )选项
物质
操作方法
A
Fe(Fe2O3)
加入过量稀盐酸,充分反应后过滤
B
CaO粉末(CaCO3粉末)
加足量的水,充分搅拌后过滤
C
NaOH溶液[Ca(OH)2溶液]
通入过量CO2气体,充分反应后过滤
D
CuSO4溶液(硫酸)
加入过量CuO粉末,加热,充分反应后过滤
A、A B、B C、C D、D12. 不用另加试剂,仅利用组内物质之间的相互反应,就能够把它们鉴别出来的是( )A、CuCl2、NaOH、HCl、H2SO4 B、HCl、NaNO3、Na2CO3、Na2SO4 C、BaCl2、K2SO4、K2CO3、HCl D、AgNO3、HCl、NaCl、HNO313. 同学们为了比较锌、铁、铜三种金属的活动性, 仅用组内物质就能达到目的的是( )①Zn、Fe、Cu、稀硫酸 ②Fe、ZnSO4 溶液、CuSO4 溶液
③Zn、FeSO4 溶液、CuSO4 溶液 ④ Zn、Cu 、FeSO4 溶液
A、①②④ B、②和③ C、只有④ D、①③④14. 向盛有20g10%氢氧化钠溶液的烧杯中逐滴滴入7.3%的稀盐酸,下列是关于溶液总质量或溶液pH随盐酸质量变化的关系图(Q点表示恰好完全反应)。其中正确的是( )A、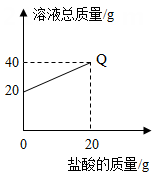 B、
B、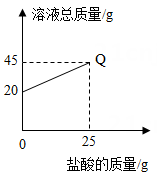 C、
C、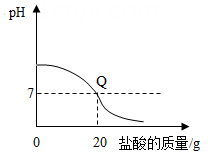 D、
D、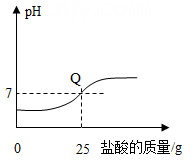 15. 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( )
15. 向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液。反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法不正确的是( ) A、图中oa段表示生成气体的过程 B、b点溶液中溶质有2种 C、c点溶液的pH>7 D、x值为106.0
A、图中oa段表示生成气体的过程 B、b点溶液中溶质有2种 C、c点溶液的pH>7 D、x值为106.0二、填空题(本题共7题,每空2分,共36分。)
-
16. 中国是全球第一个实现在海域“可燃冰”试开采中获得连续稳定产气的国家。“可燃冰”是甲烷和水在低温、高压条件下形成的水合物(CH4·nH2O)。(1)、在常温常压下,“可燃冰”会发生反应:CH4· nH2O= CH4+nH2O,该反应属于(填基本反应类型);(2)、甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH)代替日益供应紧张的燃油。甲烷制成合成气有两种方法:①CH4+H2O一定条件CO+3H2 ② 2CH4+O2一定条件2CO+4H2为了提高原子利用率,从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是(填序号)。17. 如图是铁、盐酸、氢氧化钙、硫酸铜和氯化镁五种物质的反应与转化关系,“一”表示两种物质之间能发生化学反应,“→”表示在一定条件下的物质转化。
 (1)、A物质是 (填化学式)。(2)、从物质反应规律分析,在单质、氧化物、酸、碱和盐中,
(1)、A物质是 (填化学式)。(2)、从物质反应规律分析,在单质、氧化物、酸、碱和盐中,能与B反应生成D的物质有 (填序号)。
①2类 ②3类 ③4类 ④5类
18. 人类发现二氧化碳经历了多个世纪,下列是其过程中的部分资料。资料一:1630年,海尔蒙特发现在一些洞穴处,有一种能使燃着的蜡烛熄灭的气体,后来被证实是CO2。
资料二:1754年,布莱克将石灰石锻烧首次制得CO2 , 并完成了如下所示的物质转化研究。

资料三:1766年,卡文迪许通过实验测得室温下1体积水大约能溶解1体积二氧化碳气体。
(1)、根据海尔蒙特的发现,可推测二氧化碳的化学性质:.(2)、写出布莱克实验中反应③的化学方程式:(3)、如图,在室温下将容积为200毫升的广口瓶注满蒸馏水,通过导管缓慢通入300毫升CO2。如果卡文迪许的结论是正确的,则在量筒中收集到的水约为毫升。 19. 将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如右图所示。请回答下列问题:
19. 将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如右图所示。请回答下列问题: (1)、表示锌粉与稀硫酸反应的曲线是:(填 a 或 b)(2)、对于曲线a表示的反应,(填化学式)有剩余。(3)、若有一种金属剩余,则剩余的金属一定是(填化学式)20. 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示。请回答:
(1)、表示锌粉与稀硫酸反应的曲线是:(填 a 或 b)(2)、对于曲线a表示的反应,(填化学式)有剩余。(3)、若有一种金属剩余,则剩余的金属一定是(填化学式)20. 甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如图所示。请回答: (1)、丁是 ;通常其用途为 ;(2)、乙是 ;(3)、甲和丙的化学反应方程式为 。21. A、B、C、D是初中科学常见的四种物质,其中A、B属于相同物质类别的化合物,C、D物质类别不同,它们之间的转化和反应关系如图。图中“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去。请回答:
(1)、丁是 ;通常其用途为 ;(2)、乙是 ;(3)、甲和丙的化学反应方程式为 。21. A、B、C、D是初中科学常见的四种物质,其中A、B属于相同物质类别的化合物,C、D物质类别不同,它们之间的转化和反应关系如图。图中“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去。请回答: (1)、若C是二氧化碳,B是氢氧化钙,则A是;(填名称)(2)、若C是锌,A和B都属于酸,写出D可能的化学式(物质类别不同的一种即可)。22. 有一包白色粉末,可能含有BaCl2、NaCl、CaCO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:
(1)、若C是二氧化碳,B是氢氧化钙,则A是;(填名称)(2)、若C是锌,A和B都属于酸,写出D可能的化学式(物质类别不同的一种即可)。22. 有一包白色粉末,可能含有BaCl2、NaCl、CaCO3、Na2SO4中的一种或几种。为了确定其成分,进行如下实验:①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀和滤液.
②向所得固体中加入足量稀硝酸,白色沉淀全部溶解,且有气泡产生.
③向所得滤液中加入稀硫酸,有白色沉淀生成。
据此推断,
(1)、该白色粉末中一定含有;(2)、一定不含有。三、实验探究题(本题共4小题,每空3分,共39分)
-
23. 某化学兴趣小组学习酸碱中和反应后,对稀盐酸与氢氧化钠溶液混合后的有关问题,进行了如下探究,请你一起参与他们的探究。
【提出问题】氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?
【作出猜想】
甲同学猜想:溶质有NaCl、HCl、NaOH
乙同学猜想:溶质只有NaCl
丙同学猜想:溶质有NaCl、HCl
你的猜想:溶质有 ①。(填化学式)
有同学认为②同学的猜想是错误的,理由是③。
【实验设计及验证】请你将下列实验报告填写完整:
实验操作
实验现象
实验结论
④
有气体产生
丙同学的猜想正确
取反应后的溶液于试管中,加入氯化铜溶液
⑤
你的猜想正确
24. 2008年初我国大部分地区遭受了几十年不遇的雪凝灾害。在抗凝冻过程中,工人在凝冻的道路上洒一种白色粉末后,冰雪开始融化了。小明想探究这种白色粉末的组成成分,他取少量带回实验室,并在老师的指导下和同学们一起探究。他们查阅资料、请教老师后,知道白色粉末叫“化冰盐”,且可能由NaCl、KCl、KNO3、CaCO3、MgCl2、CuSO4中的两种或两种以上的物质组成。为了探究化冰盐是由什么物质组成的,他们设计了如下方案,并进行实验。
 (1)、实验过程中操作名称:操作①为溶解,操作②为;(2)、化冰盐中一定不存在的物质是;(3)、生成沉淀B的化学方程式为;(4)、白色沉淀D生成说明“化冰盐”中NaCl。(填“一定有”、“不一定有”或“一定没有”)25. 某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为ag;③准确称得mg纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为bg.试回答:
(1)、实验过程中操作名称:操作①为溶解,操作②为;(2)、化冰盐中一定不存在的物质是;(3)、生成沉淀B的化学方程式为;(4)、白色沉淀D生成说明“化冰盐”中NaCl。(填“一定有”、“不一定有”或“一定没有”)25. 某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为ag;③准确称得mg纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为bg.试回答: (1)、若④⑤两步的实验操作太快,则会导致测定结果(填“偏大”或“偏小”);(2)、鼓入空气的目的是;(3)、若没有C装置,则会导致测定结果(填“偏大”或“偏小”);(4)、E装置的作用是;
(1)、若④⑤两步的实验操作太快,则会导致测定结果(填“偏大”或“偏小”);(2)、鼓入空气的目的是;(3)、若没有C装置,则会导致测定结果(填“偏大”或“偏小”);(4)、E装置的作用是;四、解答题(本题共6小题,第26小题6分、27小题4分、28小题8分、第29小题8分,第30小题6分,第31小题9分,,第32小题9分,共50分)
-
26. 丁酸乙脂是无色有菠萝香味的液体,其密度为0. 87g/cm3,难溶于水,可与油类互溶。现取11.6g丁酸乙脂在氧气中完全燃烧,只产生26.4gCO2和10.8gH2O。(1)、含有丁酸乙脂的物品应远离火源。若丁酸乙脂燃烧, (填“能”或 “不能”)用水来灭火。(2)、丁酸乙脂可与油类互溶,这种性质属于性质。(3)、丁酸乙脂中碳元素和氢元素的质量比为。27. 用质量分数为5%的稀盐酸和10%的氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如下图所示:
 (1)、该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。(2)、当加入溶液的质量a为20 g时,求所得溶液中溶质的质量?28. 向含CuCl2和HCl的100 克混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液200克,参加反应的NaOH溶液质量与生成沉淀Cu(OH)2质量关系如图,据图回答:
(1)、该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。(2)、当加入溶液的质量a为20 g时,求所得溶液中溶质的质量?28. 向含CuCl2和HCl的100 克混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液200克,参加反应的NaOH溶液质量与生成沉淀Cu(OH)2质量关系如图,据图回答: (1)、P点溶液中的溶质是。(2)、N点所得溶液的pH值为7(填“大于”、“等于”或“小于”)。(3)、m1为多少克?(列式计算)29. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸。已知:NaHCO3+HCl=NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验:(1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(答出一点即可)。
(1)、P点溶液中的溶质是。(2)、N点所得溶液的pH值为7(填“大于”、“等于”或“小于”)。(3)、m1为多少克?(列式计算)29. 碳酸氢钠片是一种常用药,能用于治疗胃酸过多,这是因为人体的胃液中含有盐酸。已知:NaHCO3+HCl=NaCl+H2O+CO2↑,为测定药片中碳酸氢钠的含量,小科进行了如下实验:(1)、小科认为,要测定药片中碳酸氢钠的含量,实验中需要采集两个数据:一是测出碳酸氢钠片样品的质量;二是根据碳酸氢钠与盐酸的反应原理,通过实验测出反应生成的(2)、小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸氢钠的质量分数会偏大,原因是(答出一点即可)。 (3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
(3)、为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:实验序号
1
2
3
碳酸氢钠片样品质量/克
3.0
3.0
3.0
反应前总质量/克
193.8
194.6
193.6
反应后总质量/克
192.6
193.6
192.5
二氧化碳质量/克
请计算药片中碳酸氢钠的质量分数。
30. 海螵蛸是一味中药,其主要成分是碳酸钙,某同学利用如图装置测定其中碳酸钙的含量。
①在锥形瓶中加入质量为m的海螵蛸粉末,向分液漏斗中加入稀盐酸。在烧杯中加入足量氢氧化钠溶液,并称量烧杯及氢氧化钠溶液总质量m1。
②先打开止水夹,再打开分液漏斗活塞,滴加盐酸并及时关闭活塞。完全反应后,再次称量烧杯及其中液体的总质量m2 。
③利用m2与m1的差值,即反应生成的二氧化碳质量,再计算海螵蛸中碳酸钙的含量。
(1)、海螵蛸有治疗胃酸过多、能为骨质发育提供重要元素的功效,其原因是。(2)、实验前要检查装置的气密性,方法是:用止水夹夹住橡胶管,往分液漏斗中加入适量水,打开分液漏斗的活塞,观察到 , 说明装置气密性良好。(3)、下列情况会导致海螵蛸中碳酸钙质量分数测量值偏小的是_________(可多选)A、海螵蛸中滴加盐酸过量 B、锥形瓶内部分水蒸气随二氧化碳逸出 C、反应结束后,锥形瓶内有二氧化碳残留 D、反应速度过快,大量气泡从氢氧化钠溶液中溢出31. 大理石是含杂质的碳酸钙,因具有美丽花纹面被广泛用于建筑物外墙、内壁的贴面和地面铺设。某同学想测出大理石样品中碳酸钙的含量,进行了如下实验和分析。 (1)、取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是。(2)、反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克,实验后,根据实验数据绘了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量?(3)、请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)(4)、计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是 。32. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:
(1)、取一定量的大理石样品置于图甲的发生装置中,用分液漏斗向下滴加盐酸(杂质不参加反应),产生的气体用含有碱性物质的吸收装置充分吸收。分液漏斗中所加液体不选用硫酸,理由是。(2)、反应前,测得图甲中锥形瓶内物质的总质量和吸收装置的总质量都为m克,实验后,根据实验数据绘了图乙,曲线a、b分别表示锥形瓶内物质的总质量和吸收装置的总质量随反应时间变化的情况。请根据曲线b分析计算出大理石样品中碳酸钙的质量?(3)、请综合分析曲线a、b,计算出实验中所用盐酸的溶质质量分数。(结果精确到0.1%)(4)、计算后,该同学对上述实验进行了反思。他认为分液漏斗中选用的盐酸浓度偏大,会对实验结果造成较大影响,其原因是 。32. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:①取200g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;②另取原混合溶液各200g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别
一
二
三
四
五
混合溶液质量/g
200
200
200
200
200
铁屑质量/g
6
9
12
15
18
析出铜的质量/g
6.4
9.6
m
16
16
请分析计算:
(1)、表中第三组实验的m值为。(2)、第组实验恰好完全反应。(3)、铁屑中铁的质量分数为多少?(计算结果精确到0.1%)(4)、原混合溶液中FeCl2的质量分数为多少?(计算结果精确到0.1%)