浙江省宁波市2018-2019学年九年级上学期科学期中测试卷(1-4)
试卷更新日期:2019-12-11 类型:期中考试
一、选择题(本大题共15小题,1-10题每小题4分,11-15题每小题3分,共55分。)
-
1. 下列生活用品所含的主要材料,不属于有机物的是( )A、羊毛围巾 B、纯棉毛巾 C、不锈钢碗 D、蚕丝被芯2. 金属材料已得到越来越广泛的应用.下列性质属于金属共性的是( )A、有良好的导电性、传热性 B、硬度很大、熔点很高 C、是银白色的固体 D、易与酸反应产生氢气3. 某同学出现了腹泻的症状,医生建议他暂时不吃富含油脂和蛋白质的食物,则他应该选择的早餐是( )
A、面包和牛奶 B、肉末米粉和酸奶 C、油条和豆浆 D、馒头和稀饭4. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )A、 B、
B、 C、
C、 D、
D、 5. 肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )
5. 肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如表,则新鲜肉在变质过程中酸性如何变化( )名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.6
A、变强 B、变弱 C、不变 D、无法确定6. 下列物质的名称、俗名与化学式完全对应的是( )A、氯化钠 食盐 NaCl2 B、碳酸氢钠 纯碱 NaHCO3 C、氢氧化钙 熟石灰 CaO D、氢氧化钠 火碱 NaOH7. 下列四种物质露置在空气中一段时间后,由于发生化学变化使溶液质量增加的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠溶液 D、澄清石灰水8. 科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下,有关该反应的说法正确的是( )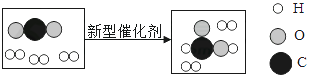 A、该反应属于化合反应 B、反应前碳元素的化合价为+2价 C、生成物的化学式可用C2H2O表示 D、参加反应的两物质的质量比为1:19. 在进行“氧气的实验室制取与性质”实验时,某同学制得的氧气不纯。你认为可能的原因是( )A、用排水法收集O2时,集气瓶先装满水 B、用向上排空气法收集O2时,导管伸入到集气瓶的底部 C、用排水法收集O2时,导管口刚冒出气泡,立即收集 D、用排水法收集O2 , 收集满后,在水下盖上玻璃片10. 有甲、乙、丙、丁四种金属.只有甲在自然界主要以游离态存在.丁盐的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放.这四种金属的活动性由强到弱的顺序是( )A、甲>乙>丁>丙 B、丙>丁>乙>甲 C、丙>乙>丁>甲 D、乙>丁>丙>甲11. 酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展。下列有关酸、碱、盐的生产或应用的说法不合理的是( )A、工业上用稀盐酸清除铁锈 B、生活中常用氢氧化钠清洗厨房油污 C、用石灰乳与硫酸铜溶液混合配制防治植物病害的波尔多液 D、汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成12. 在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示,下列说法错误的是( )
A、该反应属于化合反应 B、反应前碳元素的化合价为+2价 C、生成物的化学式可用C2H2O表示 D、参加反应的两物质的质量比为1:19. 在进行“氧气的实验室制取与性质”实验时,某同学制得的氧气不纯。你认为可能的原因是( )A、用排水法收集O2时,集气瓶先装满水 B、用向上排空气法收集O2时,导管伸入到集气瓶的底部 C、用排水法收集O2时,导管口刚冒出气泡,立即收集 D、用排水法收集O2 , 收集满后,在水下盖上玻璃片10. 有甲、乙、丙、丁四种金属.只有甲在自然界主要以游离态存在.丁盐的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放.这四种金属的活动性由强到弱的顺序是( )A、甲>乙>丁>丙 B、丙>丁>乙>甲 C、丙>乙>丁>甲 D、乙>丁>丙>甲11. 酸、碱、盐在工农业生产和日常生活中的广泛应用,促进了人类文明的进步和社会的可持续发展。下列有关酸、碱、盐的生产或应用的说法不合理的是( )A、工业上用稀盐酸清除铁锈 B、生活中常用氢氧化钠清洗厨房油污 C、用石灰乳与硫酸铜溶液混合配制防治植物病害的波尔多液 D、汽车或电动车的蓄电池中用到的硫酸溶液是由浓硫酸稀释而成12. 在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示,下列说法错误的是( )物质
a
b
c
d
反应前的质量/g
30
5
10
15
反应后的质量/g
x
y
20
20
A、a可能是反应物也可能是生成物 B、x+y=20 C、x的取值范围是0≤x≤20 D、反应生成c与d的质量比为2:113. 将一定量的锌粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中充分反应后过滤,将滤渣放入稀盐酸溶液里,有气泡产生。则下列说法正确的是( )A、滤渣中有Ag、Cu;滤液中有Mg(NO3)2和Zn(NO3)2 B、滤渣中有Ag、Cu、Zn;滤液中有Mg(NO3)2和Zn(NO3)2 C、滤渣中有Ag、Cu、Zn、Mg;滤液中有Mg(NO3)2和Zn(NO3)2 D、滤渣中有Ag、Cu、Zn;滤液中有Mg(NO3)2、Cu(NO3)2、AgNO3和Zn(NO3)214. 在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量等质量分数的足量稀盐酸,在左边烧杯中加入13g锌片,要使天平再次保持平衡,需要在右边烧杯中加入铜片的质量为( )A、13g B、12.6g C、10g D、11.6g15. 已知M、N在一定条件下,能发生反应:M+2N=P+2Q,则下列说法中不正确的是( )A、若M、N、P、Q都是由分子构成的物质,则该反应前后分子的数目一定不变 B、M、N、P、Q可能含有同一种元素 C、若16gM和64gN能恰好完全反应,则M、N的相对分子质量之比为1:2 D、若M、N、P、Q都是化合物,则该反应一定是复分解反应二、填空题(本大题共7小题,每空2分,共36分)
-
16. 稀释浓硫酸的规范操作应该选用如图中的(填字母)。不能选用另一个操作方法的原因是。
 17. “假酒中毒”事件时有发生。“假酒”一般是由工业酒精加水配制而成的,它含有一定量的甲醇(CH3OH),而饮用甲醇会使人视力迅速下降、失明,甚至死亡。根据你的理解,回答下列问题:(1)、甲醇的工业制法为:X+2H2 CH3OH,则X的化学式为。(2)、食用酒精的主要成分为乙醇(C2H5OH),乙醇是一种重要的化工原料,现在已用于制取无铅汽油。请写出乙醇燃烧的化学方程式:。(3)、与甲醇、乙醇结构相似的化合物还有丙醇(C3H7OH)、丁醇(C4H9OH)等,这类物质称为醇类.请问:其名称中的“甲、乙、丙、丁”与其分子中的有关.18. 从Zn,Fe(OH)3 , KClO3 , CaO,稀H2SO4 , H2O等物质中,选出适当的物质,按要求写出化学方程式:(1)、分解反应;(2)、置换反应;(3)、复分解反应(酸与碱反应) .19. 鉴别稀盐酸和稀硫酸可选用的试剂是;除去盐酸中混有的少量硫酸,可先加入适量的,然后,再,就可以得到较纯的盐酸。20. 如图是物质之间发生化学反应的颜色变化。
17. “假酒中毒”事件时有发生。“假酒”一般是由工业酒精加水配制而成的,它含有一定量的甲醇(CH3OH),而饮用甲醇会使人视力迅速下降、失明,甚至死亡。根据你的理解,回答下列问题:(1)、甲醇的工业制法为:X+2H2 CH3OH,则X的化学式为。(2)、食用酒精的主要成分为乙醇(C2H5OH),乙醇是一种重要的化工原料,现在已用于制取无铅汽油。请写出乙醇燃烧的化学方程式:。(3)、与甲醇、乙醇结构相似的化合物还有丙醇(C3H7OH)、丁醇(C4H9OH)等,这类物质称为醇类.请问:其名称中的“甲、乙、丙、丁”与其分子中的有关.18. 从Zn,Fe(OH)3 , KClO3 , CaO,稀H2SO4 , H2O等物质中,选出适当的物质,按要求写出化学方程式:(1)、分解反应;(2)、置换反应;(3)、复分解反应(酸与碱反应) .19. 鉴别稀盐酸和稀硫酸可选用的试剂是;除去盐酸中混有的少量硫酸,可先加入适量的,然后,再,就可以得到较纯的盐酸。20. 如图是物质之间发生化学反应的颜色变化。 (1)、根据图示内容可以总结出稀硫酸的五个化学性质。请你写出编号①稀硫酸的化学性质。(2)、若编号④的物质是盐.请你写出符合编号④的一个化学方程式:。21. 有一包固体物质,可能是无水硫酸铜、碳酸钙、氢氧化钡、氯化钠、氯化镁中的两种物质组成。为了确定其成分,某同学进行如下实验:(1)、取少量样品放入小烧杯中,加足量水充分溶解,静置,有白色沉淀生成,过滤,所得滤液无色透明。结论:这包固体中一定不存在的物质是;(2)、向(1)所得滤液中滴加无色酚酞试液,无色酚酞试液变红。结论:一定不存在的物质是。22. 如图所示A~G是初中化学常见的物质。图中 “→”表示转化关系,“—”表示相互能反应。
(1)、根据图示内容可以总结出稀硫酸的五个化学性质。请你写出编号①稀硫酸的化学性质。(2)、若编号④的物质是盐.请你写出符合编号④的一个化学方程式:。21. 有一包固体物质,可能是无水硫酸铜、碳酸钙、氢氧化钡、氯化钠、氯化镁中的两种物质组成。为了确定其成分,某同学进行如下实验:(1)、取少量样品放入小烧杯中,加足量水充分溶解,静置,有白色沉淀生成,过滤,所得滤液无色透明。结论:这包固体中一定不存在的物质是;(2)、向(1)所得滤液中滴加无色酚酞试液,无色酚酞试液变红。结论:一定不存在的物质是。22. 如图所示A~G是初中化学常见的物质。图中 “→”表示转化关系,“—”表示相互能反应。
已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物。请回答:
(1)、G的化学式为 , 写出物质B的一种用途。(2)、C、D发生反应的化学方程式可能为。三、实验探究题(本大题共4小题,每空3分,共39分)
-
23. 如图是实验室制取气体的常见装置,请回答相关问题:
 (1)、a仪器的名称为。(2)、制取气体时必须检查装置的气密性,检查装置A的气密性的方法是。(3)、实验室制取氧气时,可选用的收集装置有(填字母)。(4)、实验室制取二氧化碳时,发生装置可选择A或B,用B装置的优点之一是。24. 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。
(1)、a仪器的名称为。(2)、制取气体时必须检查装置的气密性,检查装置A的气密性的方法是。(3)、实验室制取氧气时,可选用的收集装置有(填字母)。(4)、实验室制取二氧化碳时,发生装置可选择A或B,用B装置的优点之一是。24. 实验室有一瓶保管不当的试剂(如图),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂。 (1)、根据受损标签的情况判断,这瓶试剂不可能是A、酸 B、碱 C、盐(2)、已知初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3。用pH试纸上测得该溶液的pH>7,这瓶试剂不可能是。(3)、为了确定该溶液是哪种溶液,现进行如下进一步的实验:
(1)、根据受损标签的情况判断,这瓶试剂不可能是A、酸 B、碱 C、盐(2)、已知初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3。用pH试纸上测得该溶液的pH>7,这瓶试剂不可能是。(3)、为了确定该溶液是哪种溶液,现进行如下进一步的实验:操作步骤
实验现象
结论
取样于试管中,滴加
产生大量的气泡
该溶液是
25. 实验室有一瓶久置的固体,标签上写着“氢氧化钠”。为了检验里面是否还存在NaOH,实验员取少量该固体样品进行如图实验: (1)、氢氧化钠露置于空气中容易变质,原因是(用化学方程式表示).(2)、根据溶液变红这一现象说明样品中含有 (填序号).A、CaCl2 B、Na2CO3 C、NaOH D、Na2CO3和NaOH26. 铝、铜、铁为日常生活中常见的金属.某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验。
(1)、氢氧化钠露置于空气中容易变质,原因是(用化学方程式表示).(2)、根据溶液变红这一现象说明样品中含有 (填序号).A、CaCl2 B、Na2CO3 C、NaOH D、Na2CO3和NaOH26. 铝、铜、铁为日常生活中常见的金属.某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验。 (1)、在A实验中发生反应的化学方程式为。(2)、将A实验结束后①②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤。滤渣中:一定含有的物质是。(3)、为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是(填写序号)。
(1)、在A实验中发生反应的化学方程式为。(2)、将A实验结束后①②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤。滤渣中:一定含有的物质是。(3)、为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是(填写序号)。①Al3+ ②Al3+、Fe2+ ③Al3+、Fe3+④Fe2+、Cu2+ ⑤Al3+、Fe2+、Cu2+
四、简答题(本大题共6小题,第27题6分,第28-30题每题8分,第31-32题每题10分,共50分)
-
27. 每年5、6月是蓝莓丰收的时节。蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。
 (1)、在稀盐酸中滴加花青素,溶液变。(2)、花青素分子的式量为。(3)、花青素中碳、氢、氧三种元素的质量比是。28. A、C、D是三种常见的含钙化合物,A是天然大理石和石灰石的主要成分.将A高温分解得到一种常见的温室气体B和一种氧化物C,将C溶于水得到一种常见的碱D.根据你的推断,回答下列问题:(1)、D俗称;(2)、袋装食品中常放入小袋装(透气)C,其作用是;(3)、写出B与D的水溶液反应的化学方程式;该反应产生的现象是 .29. 有A、B、C、D、E、F六种物质的稀溶液,已知它们分别是K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3中的某一种溶液。 下图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请回答下列问题:在上图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象。
(1)、在稀盐酸中滴加花青素,溶液变。(2)、花青素分子的式量为。(3)、花青素中碳、氢、氧三种元素的质量比是。28. A、C、D是三种常见的含钙化合物,A是天然大理石和石灰石的主要成分.将A高温分解得到一种常见的温室气体B和一种氧化物C,将C溶于水得到一种常见的碱D.根据你的推断,回答下列问题:(1)、D俗称;(2)、袋装食品中常放入小袋装(透气)C,其作用是;(3)、写出B与D的水溶液反应的化学方程式;该反应产生的现象是 .29. 有A、B、C、D、E、F六种物质的稀溶液,已知它们分别是K2CO3、BaCl2、Ca(NO3)2、NaCl、H2SO4、AgNO3中的某一种溶液。 下图为常温时上述溶液两两混合的部分实验现象,其中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示无明显现象或生成微溶物。请回答下列问题:在上图中的空格内用“↓”“↑”“-”表示出对应反应的实验现象。 30. 小强同学对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应).请计算:(1)、8g石灰石样品中含有杂质克。(2)、样品中碳酸钙的质量分数是。(3)、下表中m的数值为。
30. 小强同学对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8g这种石灰石样品,把40g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应).请计算:(1)、8g石灰石样品中含有杂质克。(2)、样品中碳酸钙的质量分数是。(3)、下表中m的数值为。序号
加入稀盐酸质量(g)
剩余固体质量(g)
第1次
10
5
第2次
10
m
第3次
10
1.2
第4次
10
1.2
(4)、要得到280kg CaO,需要质量分数为80%的石灰石多少千克?(化学方程式:CaCO3 CaO+CO2↑)31. 氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案: 请回答下列问题: (1)、步骤①溶解过程中用玻璃棒搅拌的目的是。(2)、步骤④⑤的顺序颠倒会引发的后果是。(3)、滤液乙中所含的溶质除氯化钠外还含有。(4)、在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是。(5)、实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有个。32. 烧杯中装有一定量盐酸和氯化铜的混合溶液,已知该溶液中含HCl溶质的质量为7.3g。某同学为测定该混合溶液中氯化铜的质量,向烧杯中逐渐加入16%的NaOH溶液,得到沉淀的质量记录如下:
请回答下列问题: (1)、步骤①溶解过程中用玻璃棒搅拌的目的是。(2)、步骤④⑤的顺序颠倒会引发的后果是。(3)、滤液乙中所含的溶质除氯化钠外还含有。(4)、在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是。(5)、实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有个。32. 烧杯中装有一定量盐酸和氯化铜的混合溶液,已知该溶液中含HCl溶质的质量为7.3g。某同学为测定该混合溶液中氯化铜的质量,向烧杯中逐渐加入16%的NaOH溶液,得到沉淀的质量记录如下:加入NaOH溶液的质量/g
30.00
60.00
90.00
120.00
150.00
生成沉淀的质量/g
0.00
1.96
7.84
9.80
9.80
(1)、得到沉淀的总质量为g,该混合溶液中氯化铜的质量为g;(2)、参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)(3)、画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线。