2016-2017学年浙江省温州市十五校联合体高一下学期期中化学试卷
试卷更新日期:2017-07-22 类型:期中考试
一、选择题
-
1. 随着人们生活质量的日益提高,废旧电池已成为一个亟待解决的问题,对废旧电池的处理 体现了对资源和环境的可持续发展.人们对废旧电池的处理的主要目的是( )A、回收电池外壳的金属材料 B、回收电池中的二氧化锰 C、回收电池中的石墨电极 D、防止电池中的重金属汞、镉、铅对土壤、水源的污染2. 1996年2月,德国某研究所在高能加速器中,将 Zn撞入一个 Pb的原子核并释放出一个中子后,合成一种人造超重元素的原子.该元素原子内中子数为( )A、278 B、277 C、166 D、1653. 下列关于燃料充分燃烧的说法中,错误的是( )A、氧气量充足,燃烧充分 B、固体燃料块越大燃烧越充分 C、液体燃料燃烧时可以雾状喷出 D、温度必须达到着火点4. 下列化学用语或模型表示正确的是( )A、NH3分子结构式:
 B、氚原子符号:21H
C、Mg2+离子的电子式:Mg:
D、C2H4分子比例模型:
B、氚原子符号:21H
C、Mg2+离子的电子式:Mg:
D、C2H4分子比例模型:  5. 下列反应中生成物总能量高于反应物总能量的是( )A、碳酸钙受热分解 B、乙醇燃烧 C、镁与稀硫酸反应 D、氧化钙溶于水6. 煤的综合利用可以获得洁净的燃料及多种化工原料.下列不属于煤的综合利用的是( )A、煤干馏 B、煤液化 C、煤气化 D、煤燃烧7. 下列关于石油加工的叙述中,不正确的是( )A、石油分馏所得的馏分是一种具有固定熔沸点的纯净物 B、石油裂化的主要目的是提高汽油等轻质油的产量 C、石油裂解的原料是石油分馏产物,包括石油气 D、石油的化学成分主要是各种液态的碳氢化合物,其中还溶有气态和固态的碳氢化合物8. 绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率最高的是( )A、NH3+H2O+CO2=NH4HCO3 B、2NH3+CO2 CO(NH2)2+H2O C、8NH3+3Cl2═N2+6NH4Cl D、2NH3+2O2 NH4NO3+H2O9. 下列化学式表示的物质一定是纯净物的是( )A、C4H10 B、C C、
5. 下列反应中生成物总能量高于反应物总能量的是( )A、碳酸钙受热分解 B、乙醇燃烧 C、镁与稀硫酸反应 D、氧化钙溶于水6. 煤的综合利用可以获得洁净的燃料及多种化工原料.下列不属于煤的综合利用的是( )A、煤干馏 B、煤液化 C、煤气化 D、煤燃烧7. 下列关于石油加工的叙述中,不正确的是( )A、石油分馏所得的馏分是一种具有固定熔沸点的纯净物 B、石油裂化的主要目的是提高汽油等轻质油的产量 C、石油裂解的原料是石油分馏产物,包括石油气 D、石油的化学成分主要是各种液态的碳氢化合物,其中还溶有气态和固态的碳氢化合物8. 绿色化学提倡化工生产应提高原子利用率.原子利用率表示目标产物的质量与生成物总质量之比.在下列氮肥的制备反应中,原子利用率最高的是( )A、NH3+H2O+CO2=NH4HCO3 B、2NH3+CO2 CO(NH2)2+H2O C、8NH3+3Cl2═N2+6NH4Cl D、2NH3+2O2 NH4NO3+H2O9. 下列化学式表示的物质一定是纯净物的是( )A、C4H10 B、C C、 D、C2H6O
10. 可以用分液漏斗进行分离的混合物是( )A、煤油与汽油的混合物 B、苯和稀硫酸的混合溶液 C、四氯化碳和苯 D、乙醇和水的混合溶液11. 下列微粒中:①13Al3+②
D、C2H6O
10. 可以用分液漏斗进行分离的混合物是( )A、煤油与汽油的混合物 B、苯和稀硫酸的混合溶液 C、四氯化碳和苯 D、乙醇和水的混合溶液11. 下列微粒中:①13Al3+②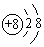 ③
③ 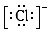 ④F﹣ , 其核外电子数相同的是( ) A、①②③ B、②③④ C、①②④ D、①③④12. 硒为第四周期VIA族元素,根据它在元素周期表中位置推测,硒不可能具有的性质是( )A、硒的氧化性比硫弱 B、可以存在至少三种以上的化合价 C、SeO3对应水化物的酸性比HBrO4弱 D、硒化氢的分子式为SeH313. 下列物质中,只含有离子键,不含有共价键的是( )A、HCl B、KOH C、CaCl2 D、NH4NO314. 实现下列变化时,需克服相同类型作用力的是( )A、水晶和干冰的熔化 B、食盐和碘的熔化 C、金刚石和白磷的熔化 D、纯碱和烧碱的熔化15. 沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )A、2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ•mol﹣1 B、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ•mol﹣1 C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ•mol﹣1 D、 CH4(g)+O2(g)═ CO2(g)+H2O(l)△H═﹣890 kJ•mol﹣116. a、b、c为短周期元素,在周期表中所处位置如表所示.a、c两元素的原子核外电子数之和等于b原子的质子数.b原子核内质子数和中子数相等.则下列说法正确的是( )
④F﹣ , 其核外电子数相同的是( ) A、①②③ B、②③④ C、①②④ D、①③④12. 硒为第四周期VIA族元素,根据它在元素周期表中位置推测,硒不可能具有的性质是( )A、硒的氧化性比硫弱 B、可以存在至少三种以上的化合价 C、SeO3对应水化物的酸性比HBrO4弱 D、硒化氢的分子式为SeH313. 下列物质中,只含有离子键,不含有共价键的是( )A、HCl B、KOH C、CaCl2 D、NH4NO314. 实现下列变化时,需克服相同类型作用力的是( )A、水晶和干冰的熔化 B、食盐和碘的熔化 C、金刚石和白磷的熔化 D、纯碱和烧碱的熔化15. 沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和H2O(l),放出445kJ热量,则下列热化学方程式中正确的是( )A、2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H═+890 kJ•mol﹣1 B、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═+890 kJ•mol﹣1 C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═﹣890 kJ•mol﹣1 D、 CH4(g)+O2(g)═ CO2(g)+H2O(l)△H═﹣890 kJ•mol﹣116. a、b、c为短周期元素,在周期表中所处位置如表所示.a、c两元素的原子核外电子数之和等于b原子的质子数.b原子核内质子数和中子数相等.则下列说法正确的是( )a
c
b
A、a的气态氢化物的水溶液呈酸性 B、c的气态氢化物的稳定性最强 C、b的氧化物的水化物是强酸 D、三种元素的原子半径c最大17. 下列关于化学反应速率的说法正确的是( )A、化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 B、化学反应速率为0.8mol/(L•s)是指1s时某物质的浓度为0.8mol/L C、根据化学反应速率的大小可以知道化学反应进行的快慢 D、决定反应速率的主要因素是反应物的浓度18. 用括号内的试剂或分离方法,除去下列各物质中少量的杂质或分离出物质,正确的是( )A、苯中的溴(碘化钾溶液) B、汽油中的苯(水) C、煤焦油中的苯、甲苯、二甲苯(分液) D、甲烷中的乙烯(溴水)19. 反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )A、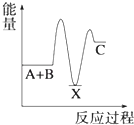 B、
B、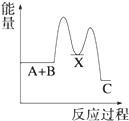 C、
C、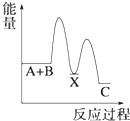 D、
D、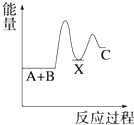 20. X2+和Y﹣与氩的电子层结构相同,下列判断中正确的是( )A、原子半径X<Y B、离子半径 X2+<Y﹣ C、X与Y的原子序数之差为8 D、在元素周期表中,两者处于同一周期21. 下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )A、②③⑦ B、①④⑥ C、②③⑥ D、①④⑤⑦22. 哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2 , 在一定条件下使该反应发生.下列说法正确的是( )A、达到化学平衡时,N2完全转化为NH3 B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 D、达到化学平衡时,正反应和逆反应速率都为零23. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
20. X2+和Y﹣与氩的电子层结构相同,下列判断中正确的是( )A、原子半径X<Y B、离子半径 X2+<Y﹣ C、X与Y的原子序数之差为8 D、在元素周期表中,两者处于同一周期21. 下列物质分子中,各原子不处于同一平面的是:①甲苯;②乙炔;③乙烯;④乙烷;⑤甲烷;⑥苯;⑦丙烯.( )A、②③⑦ B、①④⑥ C、②③⑥ D、①④⑤⑦22. 哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2 , 在一定条件下使该反应发生.下列说法正确的是( )A、达到化学平衡时,N2完全转化为NH3 B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 D、达到化学平衡时,正反应和逆反应速率都为零23. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )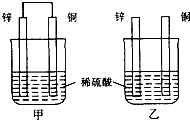 A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均减小 D、产生气泡的速度甲比乙快24. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) C、电池工作时,溶液中的OH﹣由负极向正极移动 D、外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g25. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、标准状况下,4.48 L重水(D2O)中含有的中子数为2NA B、0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA C、常温常压下,15g乙烷分子中含有的共价键数目为3NA D、273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA
A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均减小 D、产生气泡的速度甲比乙快24. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) C、电池工作时,溶液中的OH﹣由负极向正极移动 D、外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g25. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、标准状况下,4.48 L重水(D2O)中含有的中子数为2NA B、0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA C、常温常压下,15g乙烷分子中含有的共价键数目为3NA D、273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA二、非选择题
-
26. A,B,C,D,E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1.E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2﹣相同.

试回答:
(1)、元素E在元素周期表中的位置是 .(2)、与元素D离子所含电子数和质子数均相同的微粒是 .(用化学式作答,下同)
(3)、B和E最高价氧化物对应的水化物,酸性较弱的为 . 若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ , Ⅱ , 观察到的实验现象是 .(4)、由以上五种元素组成的中学常见的物质,其组成和结构信息如下表:物质
组成和结构信息
a
含有A,C,D的盐
b
C,D组成的化合物,且原子数之比为1:1
c
化学组成为AC2
①a含有的化学键有;
27.将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).
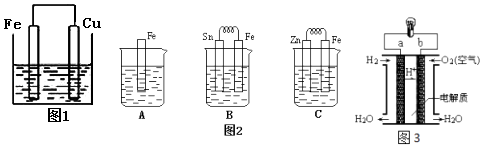 (1)、铁片上的电极反应式为 , 铜片周围溶液会出现的现象.(2)、若2min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为mol;(3)、金属的电化学腐蚀的本质是形成了原电池.如图2所示,烧杯中都盛有稀硫酸.
(1)、铁片上的电极反应式为 , 铜片周围溶液会出现的现象.(2)、若2min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为mol;(3)、金属的电化学腐蚀的本质是形成了原电池.如图2所示,烧杯中都盛有稀硫酸.①图2B中的Sn为极,Sn极附近溶液的pH(填增大、减小或不变) .
②图2C中被腐蚀的金属是 . 比较A,B,C中纯铁被腐蚀的速率由快到慢的顺序是 .
(4)、人们应用原电池原理制作了多种电池,以满足不同的需要.燃料电池是一种高效、环境友好的供电装置,如图3是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:①氢氧燃料电池的总反应化学方程式是: .
②电池工作一段时间后硫酸溶液的浓度(填“增大”、“减小”或“不变”).
28. 某温度时,在一个容积为2L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: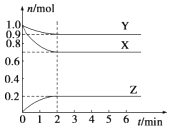 (1)、该反应的化学方程式为 .(2)、反应开始至2min,气体Z的反应速率为 .(3)、若X、Y、Z均为气体,反应达到平衡时,压强是开始时的倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热△H= .(4)、通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.已知:
(1)、该反应的化学方程式为 .(2)、反应开始至2min,气体Z的反应速率为 .(3)、若X、Y、Z均为气体,反应达到平衡时,压强是开始时的倍;此时放出了a kJ的热量,则按(1)的反应方程式写成热化学反应方程式时,该反应的反应热△H= .(4)、通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.已知:化学键
H﹣H
H﹣Cl
Cl﹣Cl
键能/KJ•mol﹣1
436
431
242
工业上通过氢气在氯气中充分燃烧制取HCl气体,写出该反应的热化学反应方程式: .
29. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO 2CO2+N2 .
(1)、写出CO2的结构式 , N2的电子式 .(2)、一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示: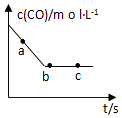
①则反应速率 (a)、 (b)、 (c)的大小关系是;
②下列可说明反应到达图中c点的是;
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
D.容器中的气体质量或物质的量保持不变
(3)、为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
实验编号
实验目的
T/℃
NO初始浓度
mol/L
CO初始浓度
mol/L
同种催化剂的比表面积
m2/g
达平衡时所用的时间min
Ⅰ
参照实验
280
6.50×10﹣3
4.00×10﹣3
80
t
Ⅱ
280
6.50×10﹣3
4.00×10﹣3
120
0.5t
Ⅲ
360
6.50×10﹣3
4.00×10﹣3
80
0.2t
【结论】①实验编号Ⅱ的实验目的为 .
②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是 , 且反应速率将 . (填“增大”、“减小”、“无影响”).
30. 根据问题填空:(1)、完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式 , 并写出其所有可能的结构简式: .(2)、两种气态烃以任意比例混合,在120℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体仍为10L.则两气态烃的分子的组成要符合的条件是 .(3)、如图所示,将浸透了石蜡油(分子中含有17个碳原子以上的液态烷烃混合物)的矿渣棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸气通过碎瓷片表面,发生反应,可得到一定量的气体生成物,用该生成物进行如下实验: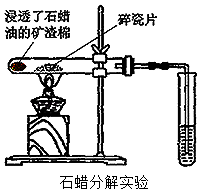
①生成的气体通入酸性KMnO4溶液中,溶液褪色.
②生成的气体通入Br2的CCl4溶液中,溶液褪色.
③用排水法收集一试管气体,点燃,燃烧时火焰明亮,有黑烟产生(甲烷燃烧时火焰为淡蓝色,无烟).
根据以上现象思考:
A.用其最简单的同系物为例,写出②的反应方程式: .
B.碎瓷片的作用是 .
C.产生黑烟的原因是 .