浙江省绍兴市诸暨市十校共进联考2019-2020学年九年级上学期科学11月份考试试卷
试卷更新日期:2019-12-03 类型:期中考试
一、选择题(本题有15小题,每小题4分,共60分。每题只有一个正确答案
-
1. 自然界的下列现象不属于化学变化的是( )A、煤矿自燃 B、下冰雹 C、树叶变黄 D、植物进行光合作用2. 下列实验操作正确的是( )A、蒸发食盐水
 B、测食盐水的pH
B、测食盐水的pH C、测食盐的质量
C、测食盐的质量 D、取适量食盐水
D、取适量食盐水 3. 下列各组中,物质的俗称、名称与化学式表示同一物质,且分类正确的是( )A、水银、银、Hg、单质 B、熟石灰、氧化钙、CaO、氧化物 C、苏打、碳酸钠、Na2CO3、盐 D、纯碱、氢氧化钠、NaOH、碱4. 现有下列5种物质:①浓盐酸 ②石灰水 ③碳酸钠晶体 ④烧碱 ⑤浓硫酸,把他们长期露置在空气中,其中会发生化学变化且质量增加的是:( )A、①、② B、②、④ C、②、③ D、④、⑤5. 下列关于能的说法,不正确的是( )A、能量无处不在,能量的形式多种多样. B、我们的生活离不开能量,即使在睡觉的时候也需要能量. C、运动的物体具有能量,静止的物体没有能量. D、所有的自然现象都涉及能量.6. 等质量的氢氧化钠溶液和稀盐酸混合后,恰好完全反应,下列说法不正确的是( )A、所用氢氧化钠溶夜和稀盐酸的溶质质量分数一定不相等 B、混合溶液中钠离子与氯离子个数相等 C、混合后水分子总数增加 D、混合前后阴离子总数不变7. 下列有关检验的说法正确的是( )A、向待测固体中加稀盐酸,产生气泡,固体中一定含有CO32﹣或HCO3﹣ B、向待测溶液中加氯化钡溶液,产生不溶于硝酸的白色沉淀,待测液中一定含SO42﹣ C、向待测溶液中加硝酸银溶液,产生白色沉淀,待测液中一定含有Cl﹣ D、向待测溶液中加氧化铜,固体消失,溶液变蓝色,待测液中一定含有H+8. 下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( )A、NaNO3 HCl Na2SO4 B、NaNO3 NaCl CuSO4 C、NaCl Na2SO4 Na2CO3 D、NaOH BaCl2 Na2SO49. 以下归纳和总结完全正确的一组是( )
3. 下列各组中,物质的俗称、名称与化学式表示同一物质,且分类正确的是( )A、水银、银、Hg、单质 B、熟石灰、氧化钙、CaO、氧化物 C、苏打、碳酸钠、Na2CO3、盐 D、纯碱、氢氧化钠、NaOH、碱4. 现有下列5种物质:①浓盐酸 ②石灰水 ③碳酸钠晶体 ④烧碱 ⑤浓硫酸,把他们长期露置在空气中,其中会发生化学变化且质量增加的是:( )A、①、② B、②、④ C、②、③ D、④、⑤5. 下列关于能的说法,不正确的是( )A、能量无处不在,能量的形式多种多样. B、我们的生活离不开能量,即使在睡觉的时候也需要能量. C、运动的物体具有能量,静止的物体没有能量. D、所有的自然现象都涉及能量.6. 等质量的氢氧化钠溶液和稀盐酸混合后,恰好完全反应,下列说法不正确的是( )A、所用氢氧化钠溶夜和稀盐酸的溶质质量分数一定不相等 B、混合溶液中钠离子与氯离子个数相等 C、混合后水分子总数增加 D、混合前后阴离子总数不变7. 下列有关检验的说法正确的是( )A、向待测固体中加稀盐酸,产生气泡,固体中一定含有CO32﹣或HCO3﹣ B、向待测溶液中加氯化钡溶液,产生不溶于硝酸的白色沉淀,待测液中一定含SO42﹣ C、向待测溶液中加硝酸银溶液,产生白色沉淀,待测液中一定含有Cl﹣ D、向待测溶液中加氧化铜,固体消失,溶液变蓝色,待测液中一定含有H+8. 下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( )A、NaNO3 HCl Na2SO4 B、NaNO3 NaCl CuSO4 C、NaCl Na2SO4 Na2CO3 D、NaOH BaCl2 Na2SO49. 以下归纳和总结完全正确的一组是( )A.对酸的认识
B.对碱的认识
①酸溶液中都存在H+
②人体胃液中含有硫酸帮助消化
③酸雨的pH小于5.6
①碱溶液中都存在OH﹣
②氢氧化钠俗称烧碱、苛性钠
③氨水可以作为氮肥使用
C.对盐的认识
D.对有机物的认识
①盐溶液都是中性的
②碳酸盐加稀盐酸都会产生CO2
③工业用盐含有毒的亚硝酸钠
①有机物都含有碳元素
②甲烷、食醋都是常见的有机物
③淀粉属于有机高分子化合物
A、A B、B C、C D、D10. 除去下列各组物质中的杂质,所用试剂和方法均正确的是:( )选项
物质
杂质
除杂所用的试剂和方法
A
CaO固体
CaCO3固体
加入适量的稀盐酸
B
NaOH溶液
Ca(OH)2溶液
先加入过量的Na2CO3溶液,再过滤
C
CO2气体
CO气体
点燃
D
H2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
A、A B、B C、C D、D11. 某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。为确认其组成,某同学取一定量该气体按如图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重2.2g。下列关于气体X成分的分析中,不正确的是( ) A、原气体中一定含有碳元素和氢元素 B、可能只有甲烷 C、可能只含有甲烷和氢气 D、可能只含有氢气和一氧化碳12. 有等质量的镁和铁,镁放入质量分数为10%的稀盐酸中,铁放入质量分数为10%的稀硫酸中,产生氢气的质量随反应时间变化曲线如图所示。下列结果可能的是( )
A、原气体中一定含有碳元素和氢元素 B、可能只有甲烷 C、可能只含有甲烷和氢气 D、可能只含有氢气和一氧化碳12. 有等质量的镁和铁,镁放入质量分数为10%的稀盐酸中,铁放入质量分数为10%的稀硫酸中,产生氢气的质量随反应时间变化曲线如图所示。下列结果可能的是( )
①反应后镁有剩余 ②反应后铁有剩余
③反应后稀硫酸有剩余 ④反应后稀盐酸有剩余
⑤消耗的铁和镁的质量相等 ⑥消耗的稀硫酸和稀盐酸质量相等
A、①③⑤ B、①②③ C、①②④ D、②③⑥13. 甲、乙、丙、丁均为初中化学常见的物质,它们之间的部分转化关系如图所示(部分反应物、生成物和反应条件已略去.“-”表示物质之间能发生化学反应,“→”表示物质之间的转化关系).下列推论不正确的是( )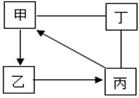 A、若甲是碳酸钙,则乙转化成丙的反应可以是放热反应 B、若甲是碳酸钠,乙是硫酸钠,则丁可以是氯化钡 C、若乙是常用的溶剂,则丁可以是单质碳 D、若丙是二氧化碳,丁是熟石灰,则丁可以通过复分解反应转化为乙14. 甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、OH-、Cl-、CO32-、SO42-中的一种阳离子和一种阴离子。为确定四溶液中分别含有哪种阳离子或阴离子,进行了下面实验:①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成;②将乙、丁溶液混合,有气泡产生;③向丙溶液中滴入AgNO3溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失;分析实验得到的以下结论,不正确的是( )A、甲溶液中一定含有Ba2+ B、乙溶液中可能含有SO42- C、丙溶液中一定含有Cl- D、丁溶液中一定含有Na+15. 如图是杂技演员演出时的过程示意图,男演员从甲处自由下落,落下后踩在跷跷板的a端,能把站在b端的女演员弹上乙处.由于存在空气阻力,下列说法不正确的是( )
A、若甲是碳酸钙,则乙转化成丙的反应可以是放热反应 B、若甲是碳酸钠,乙是硫酸钠,则丁可以是氯化钡 C、若乙是常用的溶剂,则丁可以是单质碳 D、若丙是二氧化碳,丁是熟石灰,则丁可以通过复分解反应转化为乙14. 甲、乙、丙、丁四种溶液中,分别含有Ba2+、Mg2+、Na+、H+、OH-、Cl-、CO32-、SO42-中的一种阳离子和一种阴离子。为确定四溶液中分别含有哪种阳离子或阴离子,进行了下面实验:①将甲溶液分别与其他三种溶液混合,都观察到白色沉淀生成;②将乙、丁溶液混合,有气泡产生;③向丙溶液中滴入AgNO3溶液,可明显观察到白色沉淀,加稀硝酸后,沉淀不消失;分析实验得到的以下结论,不正确的是( )A、甲溶液中一定含有Ba2+ B、乙溶液中可能含有SO42- C、丙溶液中一定含有Cl- D、丁溶液中一定含有Na+15. 如图是杂技演员演出时的过程示意图,男演员从甲处自由下落,落下后踩在跷跷板的a端,能把站在b端的女演员弹上乙处.由于存在空气阻力,下列说法不正确的是( )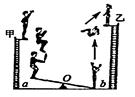 A、男演员的质量必须要大于女演员的质量 B、甲处男演员的势能一定要大于乙处女演员的势能 C、男演员离开跳台时的机械能一定大于乙处女演员的势能 D、女演员弹起时的动能与她站在乙处时的机械能相等
A、男演员的质量必须要大于女演员的质量 B、甲处男演员的势能一定要大于乙处女演员的势能 C、男演员离开跳台时的机械能一定大于乙处女演员的势能 D、女演员弹起时的动能与她站在乙处时的机械能相等二、填空题。(每空2分,共40分。
-
16. 在H、O、C、Ca几种元素中,选择元素组成符合下列要求的物质(写化学式)。(1)、天然气的主要成分;(2)、雪碧饮料中的一种酸;(3)、主要用于生产石灰和水泥的盐;(4)、常用来降低土壤酸性的是。17. 某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。
 (1)、性质2发生的化学反应属于哪类基本反应类型。(2)、根据性质5,硫酸可以与下列哪些物质发生反应 。A、烧碱溶液 B、纯碱溶液 C、氯化钡溶液 D、食盐溶液18. 在学习碱的性质时,郭老师做了如下实验:先在试管内加适量的水,然后用酒精灯加热至沸腾,然后撤去酒精灯,发现水停止沸腾了,此时向试管中马上加入氢氧化钠固体。请回答:(1)、加入固体后可以观察的实验现象是;(2)、这个实验可以说明氢氧化钠固体具有性质。19. 为了验证铁、铜、银的金属活动性顺序,设计了如下实验:Ⅰ.将铁片浸入稀硫酸;Ⅱ.将铜片浸入稀硫酸;Ⅲ.将铁片浸入硝酸银溶液(1)、写出实验Ⅲ发生的化学方程式.(2)、上述实验(选填“能”或“不能”)验证三种金属的活动性顺序。(3)、将铁、铜、银三种金属浸入溶液(只填一种),即可验证它们的活动性顺序20. 如图是皮球落地后弹跳过程中,每隔相等时间曝光一次所拍摄的照片。A、B是同一高度的两点,则A点的动能B点的动能(选填“大于”“小于”或“等于”);此过程中皮球的机械能(选填“增大”“减小”或“不变”)
(1)、性质2发生的化学反应属于哪类基本反应类型。(2)、根据性质5,硫酸可以与下列哪些物质发生反应 。A、烧碱溶液 B、纯碱溶液 C、氯化钡溶液 D、食盐溶液18. 在学习碱的性质时,郭老师做了如下实验:先在试管内加适量的水,然后用酒精灯加热至沸腾,然后撤去酒精灯,发现水停止沸腾了,此时向试管中马上加入氢氧化钠固体。请回答:(1)、加入固体后可以观察的实验现象是;(2)、这个实验可以说明氢氧化钠固体具有性质。19. 为了验证铁、铜、银的金属活动性顺序,设计了如下实验:Ⅰ.将铁片浸入稀硫酸;Ⅱ.将铜片浸入稀硫酸;Ⅲ.将铁片浸入硝酸银溶液(1)、写出实验Ⅲ发生的化学方程式.(2)、上述实验(选填“能”或“不能”)验证三种金属的活动性顺序。(3)、将铁、铜、银三种金属浸入溶液(只填一种),即可验证它们的活动性顺序20. 如图是皮球落地后弹跳过程中,每隔相等时间曝光一次所拍摄的照片。A、B是同一高度的两点,则A点的动能B点的动能(选填“大于”“小于”或“等于”);此过程中皮球的机械能(选填“增大”“减小”或“不变”) 21. 往一定量的酸(或碱)溶液中逐滴加入某碱(或酸)溶液时,溶液的pH随滴加的某溶液质量的变化而变化的关系如下图所示。请回答:
21. 往一定量的酸(或碱)溶液中逐滴加入某碱(或酸)溶液时,溶液的pH随滴加的某溶液质量的变化而变化的关系如下图所示。请回答: (1)、有同学根据右下图中的曲线判断实验中采用了A和B中的哪一个装置的操作?。(2)、在以上实验中用了酚酞作指示剂,能够说明盐酸和氢氧化钠溶液恰好完全中和的实验现象是。22. 等质量、颗粒相似的A、B两种活泼金属与足量相同质量分数的稀盐酸反应,产生H2质量与反应时间的关系如图所示。
(1)、有同学根据右下图中的曲线判断实验中采用了A和B中的哪一个装置的操作?。(2)、在以上实验中用了酚酞作指示剂,能够说明盐酸和氢氧化钠溶液恰好完全中和的实验现象是。22. 等质量、颗粒相似的A、B两种活泼金属与足量相同质量分数的稀盐酸反应,产生H2质量与反应时间的关系如图所示。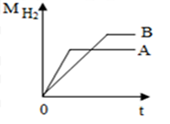 (1)、A、B两种金属的活动性大小关系是:AB。(选填“大于”或“小于”)(2)、在Mg、Fe、Zn、Al中选择,则A、B两种金属可能是。
(1)、A、B两种金属的活动性大小关系是:AB。(选填“大于”或“小于”)(2)、在Mg、Fe、Zn、Al中选择,则A、B两种金属可能是。a.Mg和Fe b.Zn和Fe c.Mg和Zn d.Al和Mg e.Al和Zn
23. 黑白复印机用的墨粉中常添加Fe3O4粉末.Fe3O4是由Fe2+、Fe3+和O2﹣按1:2:4的个数比构成的.下图是氧化沉淀法生产复印用Fe3O4粉末的流程简图.已知第④步反应中各元素化合价保持不变.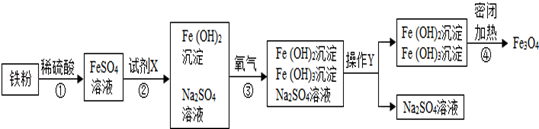 (1)、Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是色.(2)、第②步加入试剂X,生成Fe(OH)2的反应方程式为.(3)、在第③步反应中要控制通入O2的量,以使生成的Fe(OH)2和Fe(OH)3的质量比等于 , 才能确保最终生成Fe3O4.
(1)、Fe3O4粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了Fe3O4有磁性,还利用了Fe3O4是色.(2)、第②步加入试剂X,生成Fe(OH)2的反应方程式为.(3)、在第③步反应中要控制通入O2的量,以使生成的Fe(OH)2和Fe(OH)3的质量比等于 , 才能确保最终生成Fe3O4.三、探究题(每空3分,共45分。
-
24. 小海探究氢氧化钠固体溶于水时其温度的变化后,由于疏忽,未将盛氢氧化钠固体试剂的瓶塞塞紧,一段时间后,它可能变质了。该反应的化学方程式为:。
小海对该样品进行了系列探究:
[提出问题1]:该样品真的变质了吗?
[实验方案1]:取该样品少量于试管里,加入适量的水,振荡,样品全部溶于水,再向其中滴加过量的稀盐酸溶液,观察到说明样品真的变质了。
[提出问题2]:该样品是部分变质还是全部变质?
[实验方案2]:取该样品少量于烧杯里,加适量的水,搅拌,全部溶解后,再向其中加入溶液,然后过滤,再向滤液里滴加无色酚酞试液,观察到变成红色,说明该样品是部分变质.
[提出问题3]:怎样除去样品中的杂质?
[实验方案3]:将样品全部溶于水,向其中加入适量的 溶液,然后过滤,再将滤液蒸干,即得到纯净的氢氧化钠固体。
25. 学习了“物体的动能与什么因素有关”的实验后,小军开展了如图甲的实验:
步骤一:让铁球甲从斜面E点静止滚下,打到A处木块,推动木块;
步骤二:让铁球甲从斜面F点滚下,打到A处相同的木块,推动木块;
步骤三:换一铁球乙(m乙>m甲)从斜面上F点静止滚下,打到A处相同的木块,推动木块。
(1)、铁球动能的大小事通过来反应,这种研究方法叫转换法。(2)、实际操作中,小军发现几次木块并未发生移动,对此你建议的改进方法(3)、为了让质量不同的甲、乙两球获得相同的初速度,有同学认为可以不用让两球都从E点滚下,而是设计了如图乙装置,只要每次让两球压缩弹簧到同样的形变程度后自然释放即可。不考虑各种能量损耗,该方法是否合理,并说明理由。26. 氮化铝(AlN)是一种新型材料。某氮化铝样品中含有碳或氧化铝杂质。已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体。现用如图所示中的一些装置来进行相关实验。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。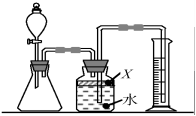 (1)、实验操作为:
(1)、实验操作为:a.往锥形瓶中放入适量的AlN样品;
b.打开分液漏斗的活塞往锥形瓶中加入过量的浓NaOH;
c.检验装置气密性
d.测定收集到水的体积。
正确的操作顺序为(用a、b、c、d字母表示)。
(2)、广口瓶中的试剂X宜选用 (填写序号)。A、稀硫酸 B、植物油 C、酒精 D、水(3)、若广口瓶内的液体没有装满(上方留有少量空间),则实验测得NH3体积将(选填“偏大”、“偏小”或“无影响”)(4)、实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是。27. 某科学小组向一定量AgNO3和Cu(NO3)2混合溶液中加入一定量的Mg粉,充分反应后过滤得溶液A和固体B(1)、【实验猜想】对滤液A所含的溶质有以下几种猜想:①Mg(NO3)2、AgNO3、Cu(NO3)2 ②Mg(NO3)2、Cu(NO3)2
③Mg(NO3)2、AgNO3 ④只有Mg(NO3)2
经过讨论大家一致认为不合理的猜想是(填标号)。理由是.
(2)、【实验探究】若猜想④成立,通过以下实验可确定固体B的成分,请将下表填写完整。实验步骤
现象
固体B的成分
有气泡产生
四、分析计算题(10+6+6+6+9+8+10共55分
-
28. 尿素[CO(NH2)2]在工农业生产中应用广泛.尿素溶液能除工业废气Cl2化学方程式为:CO(NH2)2+H2O+3Cl2=X+CO2+6HCl,(1)、则X的化学式是.(2)、尿素是目前使用量较大的一种(选填“氮”、“磷”或“钾”)肥,也是一种(选填“氧化物”、“酸”、“碱”、“盐”或“有机物”)适用于各种植物。(3)、尿素中碳元素和氮元素的质量比为.(4)、现有100克质量分数为6%的尿素溶液,理伦上可以吸收克氯气(Cl2).29. 2019年10月10日据“中央社”报道,日本学者吉野彰及另两位英美学者因为对研发锂离子电池贡献卓著,共同荣获2019年诺贝尔化学奖。锂离子电池在各方面都有广泛的应用。如图最近兴起的智轨电车也用到了锂离子电池。其中胶轮、自动导向、锂离子电池供电是智轨电车的三大标签。请回答:
 (1)、写出锂元素的符号.(2)、锂离子电池供电过程中能量转化是.(3)、智轨电车的胶轮轮胎是由合成材料和金属材料复合而成,其中使用的合成材料是合成橡胶,主要利用它的 等性能(填字母)。A、透气性好、耐磨 B、耐高温、高弹性 C、密度小、熔点低 D、绝缘性好、耐低温30. 学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
(1)、写出锂元素的符号.(2)、锂离子电池供电过程中能量转化是.(3)、智轨电车的胶轮轮胎是由合成材料和金属材料复合而成,其中使用的合成材料是合成橡胶,主要利用它的 等性能(填字母)。A、透气性好、耐磨 B、耐高温、高弹性 C、密度小、熔点低 D、绝缘性好、耐低温30. 学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:实验
一
二
三
四
加入样品的质量/g
5
10
15
20
生成CO2的质量/g
0.88
1.76
m
2.2
(1)、上表中m的数值是。(2)、这种石灰石矿中碳酸钙的质量分数是。(3)、稀盐酸中溶质的质量分数是?(写出计算过程)31. 说理:用学过的科学知识解释,在稀释浓硫酸时为什么不能把水倒入浓硫酸中?32. 在一烧杯中盛有150gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示. (1)、在实验过程中,AB段看到的明显实验现象是.(2)、当滴入的Na2CO3溶液80克时,所得溶液中的溶质为.(3)、求原溶液中HCl的质量分数为.(计算结果精确到0.1%)(4)、当滴入Na2CO3溶液至图中B点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到0.1%)33. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:
(1)、在实验过程中,AB段看到的明显实验现象是.(2)、当滴入的Na2CO3溶液80克时,所得溶液中的溶质为.(3)、求原溶液中HCl的质量分数为.(计算结果精确到0.1%)(4)、当滴入Na2CO3溶液至图中B点时,通过计算求所得不饱和溶液中溶质质量分数为多少?(计算结果精确到0.1%)33. 为测定CuCl2和FeCl2组成的混合溶液中FeCl2的质量分数进行如下实验:①取100g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到179.375gAgCl固体;
②另取原混合溶液各100g与含有杂质的废铁屑反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
实验组别
一
二
三
四
五
混合溶液质量/g
100
100
100
100
100
铁屑质量/g
6
9
12
15
18
析出铜的质量/g
3.2
4.8
6.4
8
8
请分析计算:
(1)、第组实验恰好完全反应。(2)、铁屑中铁的质量分数为多少?(计算结果精确到0.1%)(3)、原混合溶液中FeCl2的质量分数为多少?34. 某铁矿粉,主要成分为铁的氧化物(FeXOy),一学生利用实验作进一步分析,过程及数据如下。(注:铁矿粉中杂质不参与下列过程中的反应)ⅰ.取30g该铁矿粉在CO气流中充分加热,将反应后的气体用烧碱溶液充分吸收,烧碱溶液增重19.8g;
ⅱ.将上述加热后的固体取出后,再向固体逐滴加入稀硫酸,测得产生气体与滴入稀硫酸的质量关系如下图:

通过计算回答下列问题:
(1)、过程ⅰ中生成气体的质量g,过程ⅱ中固体充分反应后,产生气体的质量为g。(2)、所用稀硫酸溶液的溶质质量分数为。(3)、30g铁矿粉所含铁的氧化物中,氧元素的质量为g。(4)、通过计算可知该铁的氧化物的化学式为。