2016-2017学年四川省成都市九校联考高一下学期期中化学试卷
试卷更新日期:2017-07-22 类型:期中考试
一、选择题
-
1. 化学与生活、科技关系密切.下列说法正确的是( )A、液氨可用作制冷剂是因为其气化时可放出大量的热 B、将青蒿在乙醚中浸取,通过分馏可提取治疗疟疾的青蒿素 C、钢制品、铝制品在日常生活中被广泛应用是因为铁、铝为活泼金属 D、久置的漂白粉变质是因为漂白粉与空气中的O2反应2. 下列物质的分类合理的是( )A、酸性氧化物:CO2、SiO2、SO2、NO2 B、碱:NaOH、KOH、Ba(OH)2、纯碱 C、混合物:盐酸 漂白粉 水煤气 氢氧化铁胶体 D、碱性氧化物:Na2O2、CaO、MgO、Al2O33. 用NA表示阿伏加德罗常数,下列叙述不正确的是( )A、常温常压下,7.8 gNa2O2含有的Na+数为0.2NA B、标准状况下,22.4 LCl2与水充分反应,转移的电子数为NA C、标准状况下,NA个CO2与SO2的混合气体分子占有的体积约为22.4 L D、50℃、1×105Pa下6g NO2与0℃、2×105 Pa下46 g N2O4均含有3NA个原子4. 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2 2Na2FeO4+Na2O,下列说法不正确的是( )A、该反应中Na2O2既是氧化剂又是还原剂 B、Na2FeO4既是氧化产物又是还原产物 C、1mol Na2O2发生反应,有2mol电子转移 D、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌5. 溶液中可能大量存在的一组离子是( )A、H+、Cl﹣、PO43﹣、Na+ B、H+、Fe2+、SO42﹣、NO C、K+、H+、NO 、Na+ D、OH﹣、Br﹣、SO42﹣、NH4+6. 下列实验中,操作和现象均正确且能实现相应实验目的是( )
选项
实验目的
操作
现象
A
验证BaSO3难溶于水
将SO2通入Ba(NO3)2溶液中
有白色沉淀生成
B
验证非金属性:Br>I
将溴水滴加到淀粉KI溶液中
溶液变蓝
C
验证SO2的漂白性
将SO2通入氯水中
氯水褪色
D
验证某化合物是钠盐
将该化合物在酒精灯上灼烧
焰色为黄色
A、A B、B C、C D、D7. 物质氧化性、还原性的强弱,不仅与物质的结构、性质有关,还与物质的浓度和反应温度有关.下列各组物质:由于浓度不同而能发生不同氧化还原反应的是( )①Cu与HNO3溶液
②Cu与FeCl3溶液
③Zn与H2SO4溶液
④Fe与HCl溶液.
A、①③ B、③④ C、①② D、①③④8. 下列装置所示的实验中,能达到实验目的是( )A、 分离碘和酒精
B、
分离碘和酒精
B、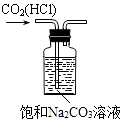 除去CO2中的HCl
C、
除去CO2中的HCl
C、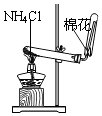 实验室制氨气
D、
实验室制氨气
D、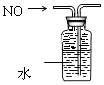 排水法收集NO
9. 对于下列事实的解释错误的是( )A、在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 B、Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 D、向碘水中滴加CCl4 , 振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘10. 从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是( )A、Cu+HNO3(浓)→Cu(NO3)2 B、Cu+HNO3(稀)→Cu(NO3)2 C、Cu CuO Cu(NO3)2 D、Cu CuSO4 Cu(NO3)211. 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )
排水法收集NO
9. 对于下列事实的解释错误的是( )A、在蔗糖中加入浓硫酸后出现发黑的现象,说明浓硫酸具有脱水性 B、Na的金属活动性比Mg强,说明可用Na与MgCl2溶液反应制Mg C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸反应生成了致密的氧化物 D、向碘水中滴加CCl4 , 振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘10. 从经济效益和环境保护的角度考虑,大量制取硝酸铜最宜采用的方法是( )A、Cu+HNO3(浓)→Cu(NO3)2 B、Cu+HNO3(稀)→Cu(NO3)2 C、Cu CuO Cu(NO3)2 D、Cu CuSO4 Cu(NO3)211. 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是( )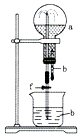
a(干燥气体)
b(液体)
A
NO2
水
B
CO2
CaCl2溶液
C
Cl2
饱和NaCl溶液
D
NH3
水
A、A B、B C、C D、D12. 下列反应离子方程式正确的是( )A、向NaOH溶液中通入氯气:2OH﹣+Cl2═Cl﹣+ClO﹣+H2O B、氨气与盐酸反应:NH3+HCl═NH4++Cl﹣ C、碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O D、将稀硝酸滴在铁片上:Fe+2H+═Fe2++H2↑13. 下列有关性质的比较,不能用元素周期律解释的是( )A、非金属性:Cl>Br B、酸性:H2SO3>H2CO3 C、碱性:KOH>NaOH D、热稳定性:NH3>PH314. 关于碱金属单质的性质叙述错误的是( )A、都能够在空气中剧烈燃烧 B、都能够与水反应生成碱和H2 C、都可以保存在煤油中 D、都是密度比较小、熔点比较低的金属15. 对增生性瘢痕早期进行 Sr(锶)干预可取得较好效果.下列说法正确的是( )A、Sr为于第4周期ⅡA 族 B、 Sr核内中子数与质子数之差为14 C、 Sr与 Y互为同位素 D、 Sr的核内质子数为38,Sr元素的相对原子质量为9016. 下列关于卤族元素(X)及其化合物叙述错误的是( )A、单质均有颜色,随原子序数递增颜色加深 B、HX随原子序数递增稳定性逐渐减弱 C、单质(除F2)均能与水反应形成HX和HXO,HXO的结构式为:H﹣X﹣O D、HX中除HF分子间存在氢键,其余HX分子均不存在氢键17. 下列关于原子结构与元素性质的说法正确的是( )A、同种元素的原子均有相同的质子数和中子数 B、全部由非金属元素组成的化合物中只含共价键 C、ⅦA族元素是同周期中非金属性最强的元素 D、同一主族的元素,原子半径越大,其单质的熔点一定越高18. A,B,C均为短周期的元素,它们在周期表的位置如图.已知:B,C元素的原子序数之和是A 元素的原子序数的4倍,则A,B,C分别是( )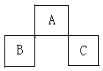 A、Be、Na、Al B、O、P、Cl C、P、O、Cl D、C、Al、P19. 短周期元素W、X、Y、Z原子序数依次减小,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且Y的原子半径大于Z.下列叙述正确的是( )A、原子半径:W>X>Y B、X的单质不能与Z的氧化物反应 C、W的单质在Y的单质中燃烧产生淡蓝色火焰 D、X、Y可形成既有离子键又有共价键的离子化合物20. 短周期元素X和Y,可组成化合物XY3 . 当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a﹣6,其中正确的组合是( )A、①② B、①②③ C、①②③⑤ D、①②④⑤21. Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )A、氯化物 B、硫酸盐 C、硝酸盐 D、碳酸盐22. 某固体化合物的化学式NH5 , 它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )A、它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ B、NH5中只有极性共价键的共价化合物 C、1molNH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数) D、NH5中所有原子最外层均为8个电子
A、Be、Na、Al B、O、P、Cl C、P、O、Cl D、C、Al、P19. 短周期元素W、X、Y、Z原子序数依次减小,它们原子的最外层电子数之和为14.X与Z同主族,Y与W同主族,且Y的原子半径大于Z.下列叙述正确的是( )A、原子半径:W>X>Y B、X的单质不能与Z的氧化物反应 C、W的单质在Y的单质中燃烧产生淡蓝色火焰 D、X、Y可形成既有离子键又有共价键的离子化合物20. 短周期元素X和Y,可组成化合物XY3 . 当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a﹣6,其中正确的组合是( )A、①② B、①②③ C、①②③⑤ D、①②④⑤21. Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )A、氯化物 B、硫酸盐 C、硝酸盐 D、碳酸盐22. 某固体化合物的化学式NH5 , 它的所有原子的最外层都符合稀有气体原子的电子层结构,则下列说法中,正确的是( )A、它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ B、NH5中只有极性共价键的共价化合物 C、1molNH5中含有5NA个N﹣H键(NA表示阿伏加德罗常数) D、NH5中所有原子最外层均为8个电子二、填空题
-
23. 下列物质中:
①N2、②MgCl2、③NH4Cl、④ZnSO4、⑤CO2、⑥HClO4、⑦KOH、⑧H3PO4(填编号)
(1)、属于非电解质的是;属于弱电解质的是 .(2)、属于共价化合物的是;不含有共价键的离子化合物是 .(3)、既含有离子键又含有共价键的是 .24. 写出化学方程式或离子方程式:(1)、碳和浓硫酸反应的化学方程式 .(2)、Na2O2和水反应的离子方程式 .(3)、NH3的催化氧化反应化学方程式 .25. 表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白:主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
④
3
⑤
⑥
⑦
⑧
(1)、在最高价氧化物的水化物中,酸性最强的化合物的名称是 , 碱性最强的化合物的化学式是 .(2)、⑤⑦形成化合物的电子式 . ②形成的最高价氧化物的结构式 .(3)、最高价氧化物是两性氧化物的元素其元素符号是;写出它的氢氧化物与⑧的最高价氧化物的水化物反应的离子方程式 .(4)、⑥的单质与⑤的最高价氧化物的水化物反应的离子方程式是 .(5)、②和⑦可形成原子数1:2的液态化合物甲,并能溶解⑦的单质,用电子式表示甲的形成过程: .26. 现有部分元素的性质、用途与原子(或分子)结构如表所示:元素编号
元素性质与原子(或分子)结构
W
周期表中原子半径最小的元素
X
氢化物可与其最高价氧化物的水化物反应生成盐
Y
一种核素在考古时常用来鉴定一些文物的年代
Z
M层比K层少1个电子
T
存在两种同素异形体,其中一种可吸收紫外线
(1)、元素Y在周期表中的位置第 , 元素T的简单离子结构示意图 .(2)、W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .(3)、元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 丙+丁,该反应为: .(4)、元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式 .27. 为了验证SO2的性质,某同学利用输液管设计了如图1微型实验: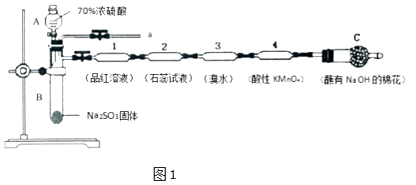
回答下列问题:
(1)、仪器A的名称是 .(2)、装置l中的现象是;装置3中证明SO2具有性.(3)、下列说法正确的是 .A、装置2中紫色石蕊试液变红的原因是SO2+H2O=H2SO3 , H2SO3显酸性 B、实验结束后将输液管1加热溶液不变色 C、实验结束后,可由a导管向装置中加水,将气体赶出后再拆装置,防止残留的SO2有毒气体污染环境 D、在a导管处用向下排空气法收集SO2(4)、装置4中酸性高锰酸钾褪色,经测定反应后溶液中含有Mn2+和SO42﹣ , 请写出该反应的离子方程式 .(5)、该学生还利用上图部分仪器组装成的装置(如图2)证明S、C、Si非金属性强弱.可共选择的试剂有:硫酸、亚硫酸、硝酸、木炭、硅酸钠溶液.
①装置A中试剂X是;装置1中反应的化学方程式是 .
②实验结论:因为酸性强弱是>>(填化学式),故非金属性是S>C>Si.
28. 富铁铝土矿(主要含有Al2O3、Fe2O3、FeO和SiO2)可用于制备净水剂明矾KAl(SO4)2•12H2O和补血剂FeSO4•7H2O.工艺流程如下(部分操作和产物略去):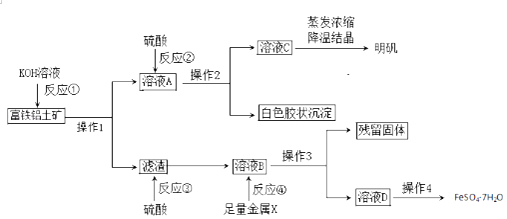 (1)、操作1的名称是 .(2)、反应①②③④中是氧化还原反应的是(填写编号).(3)、综合考虑,金属X最好选择的试剂是 , 写出该反应离子方方程式 .(4)、反应①的离子方程式是、 .(5)、溶液D中含有的金属阳离子是 , 检验方法是 .(6)、用含铝元素27%的上述矿石10吨,通过上述流程最多生产明矾吨.
(1)、操作1的名称是 .(2)、反应①②③④中是氧化还原反应的是(填写编号).(3)、综合考虑,金属X最好选择的试剂是 , 写出该反应离子方方程式 .(4)、反应①的离子方程式是、 .(5)、溶液D中含有的金属阳离子是 , 检验方法是 .(6)、用含铝元素27%的上述矿石10吨,通过上述流程最多生产明矾吨.