2016-2017学年山西省运城市绛县高一下学期期中化学试卷
试卷更新日期:2017-07-22 类型:期中考试
一、选择题
-
1. 根据元素所在元素周期表的位置,判断下列元素都能作为半导体材料的是( )A、S,K B、C,Al C、Si、Ge D、Ag、Cu2. 下列比较错误的是( )A、金属性:Na>Mg>Al B、非金属性:Cl>S>P>Si C、碱性:NaOH>Mg(OH)2>Al(OH)3 D、酸性:HClO>H2SO3>H3PO4>H2SiO33. 关于化学键的下列叙述中,下列叙述不正确的是( )A、离子化合物可能含共价键 B、共价化合物可能含离子键 C、离子化合物中必含离子键 D、共价化合物中不含离子键4. 下列各组粒子中属于同位素的是( )A、16O和18O B、H2O和D2O C、H2和D2 D、24Mg和24Na5. 下列关于元素周期表和元素周期律的说法错误的是( )A、Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 B、第二周期元素从Li到F,非金属性逐渐增强 C、因为Na比K容易失去电子,所以Na比K的还原性强 D、O与S为同主族元素,且O比S的非金属性强6. 下列物质的电子式书写正确的是( )A、氯化氢
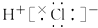 B、二氧化碳
B、二氧化碳 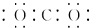 C、氮气
C、氮气 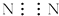 D、氯化镁
D、氯化镁  7. A,B,C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极.A,B,C三种金属的活动性顺序为( )A、C>B>A B、B>C>A C、A>B>C D、A>C>B8. 下列各图中,表示吸热反应的图是( )A、
7. A,B,C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极.A,B,C三种金属的活动性顺序为( )A、C>B>A B、B>C>A C、A>B>C D、A>C>B8. 下列各图中,表示吸热反应的图是( )A、 B、
B、 C、
C、 D、
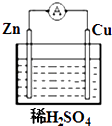
D、 9. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、锌粒与稀硫酸的反应 B、灼热的木炭与CO2反应 C、甲烷在氧气中的燃烧反应 D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应10. 如图所示的装置中,属于原电池的是( )
9. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、锌粒与稀硫酸的反应 B、灼热的木炭与CO2反应 C、甲烷在氧气中的燃烧反应 D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应10. 如图所示的装置中,属于原电池的是( )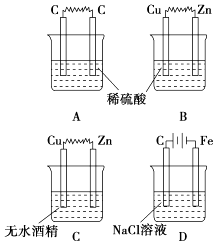 A、
A、 B、
B、 C、
C、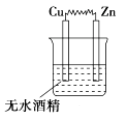 D、
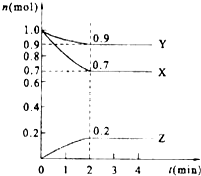
D、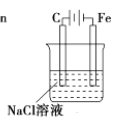 11. 下列叙述中错误的是( )A、原子半径:Cl>S>O B、还原性:Na>Mg>Al C、稳定性:HF>HCl>HBr D、酸性:HClO4>H2SO4>H3PO412. X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )A、原子序数X<Y B、原子半径X<Y C、离子半径X>Y D、原子最外层电子数X<Y13. 下列各组元素中,按最高正价递增的顺序排列的是( )A、N、O、F B、Li、Al、Mg C、Li、B、C D、Cl、Br、I14. 在2L密闭容器中,某气体反应物在2s内由8mol变为7.2mol,则用此反应物表示该反应的平均反应速率为( )A、0.4 mol•(L•s)﹣1 B、0.3 mol•(L•s)﹣1 C、0.2 mol•(L•s)﹣1 D、0.1 mol•(L•s)﹣115. 对于可逆反应M+N⇌Q 达到平衡时,下列说法中,正确的是( )A、M、N全部变成了Q B、M、N、Q三种物质的浓度一定相等 C、反应已经停止 D、反应混合物各成分的百分组成不再变化16. 铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )A、滴加少量硫酸铜溶液 B、不用铁片,改用铁粉 C、不用稀硫酸,改用98%浓硫酸 D、加热
11. 下列叙述中错误的是( )A、原子半径:Cl>S>O B、还原性:Na>Mg>Al C、稳定性:HF>HCl>HBr D、酸性:HClO4>H2SO4>H3PO412. X元素的阳离子与Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )A、原子序数X<Y B、原子半径X<Y C、离子半径X>Y D、原子最外层电子数X<Y13. 下列各组元素中,按最高正价递增的顺序排列的是( )A、N、O、F B、Li、Al、Mg C、Li、B、C D、Cl、Br、I14. 在2L密闭容器中,某气体反应物在2s内由8mol变为7.2mol,则用此反应物表示该反应的平均反应速率为( )A、0.4 mol•(L•s)﹣1 B、0.3 mol•(L•s)﹣1 C、0.2 mol•(L•s)﹣1 D、0.1 mol•(L•s)﹣115. 对于可逆反应M+N⇌Q 达到平衡时,下列说法中,正确的是( )A、M、N全部变成了Q B、M、N、Q三种物质的浓度一定相等 C、反应已经停止 D、反应混合物各成分的百分组成不再变化16. 铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )A、滴加少量硫酸铜溶液 B、不用铁片,改用铁粉 C、不用稀硫酸,改用98%浓硫酸 D、加热二、非选择题
-
17. 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.表列出了①~⑨九种元素在周期表中的位置.
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
②
3
③
④
⑤
⑥
⑦
4
⑧
⑨
请回答:
(1)、这九种元素分别是①(填元素符号,下同)、②、③、④、⑤、⑥、⑦、⑧、⑨ , 其中化学性质最不活泼的是 .(2)、在③④⑤三种元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式).其中③⑤元素的最高价氧化物对应的水化物发生反应的化学方程式为 .(3)、①、②、③三种元素按原子半径由大到小的顺序依次为(填元素符号).(4)、⑧元素与⑥元素形成的化合物高温下灼烧时,火焰呈色.如何观察 .18. 下列物质中:①CO2②Ar、③SiO2、④NaOH、⑤NaF、⑥KOH、⑦CaCl2、⑧Na2O2、⑨H2O、⑩N2 , 只含有共价键的物质是;只含有离子键的物质是;既含有离子键,又含有共价键的是;不存在化学键的是 . (填写序号)19. 用电子式表示下列物质:CaCl2
H2S:
NaOH: .