2016-2017学年山西省太原市高一下学期期中化学试卷
试卷更新日期:2017-07-22 类型:期中考试
一、选择题
-
1. 制出了第一张元素周期表的科学家是( )A、勒夏特列 B、汤姆生 C、阿伏加德罗 D、门捷列夫2. 近年来我国加强了稀土资源的保护.铈(Ce)是一种稀土元素,它的一种核素中含有58个质子和80个中子,则其表示为( )A、 Ce B、 Ce C、 Ce D、 Ce3. 自热视频已成为现代生活的时尚.自热食品包装中有两包发热剂,在这两包发热剂中最适合盛饭的物质是( )A、熟石灰和水 B、生石灰和水 C、氯化钠和水 D、氯化铵和氢氧化钡晶体4. 元素的种数与原子的种数相比( )A、前者多 B、后者多 C、一样多 D、无法确定5. 下列食品添加剂中,其使用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、增稠剂6. 目前,我市电能的主要来源是火力发电. 下列关于火力发电过程中能量转化关系的描述,正确的是( )
 A、化学能转化成机械能在转化成电能 B、化学能转化成热能在转化成电能 C、化学能转化成机械能在转化成热能在到机械能 D、化学能转化成热能在转化成机械能在到电能7. 科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )A、任意位置寻找 B、稀有气体元素中寻找 C、金属和非金属的分界线处寻找 D、活泼金属和活泼非金属区中寻找8. 下列物质中,属于共价化合物的是( )A、氯化镁 B、二氧化碳 C、氢气 D、硫酸铜9. 下列电子式的书写正确的是( )A、Mg2+ B、S2﹣ C、
A、化学能转化成机械能在转化成电能 B、化学能转化成热能在转化成电能 C、化学能转化成机械能在转化成热能在到机械能 D、化学能转化成热能在转化成机械能在到电能7. 科学家们欲寻找一种新型的半导体材料,可以在元素周期表的( )A、任意位置寻找 B、稀有气体元素中寻找 C、金属和非金属的分界线处寻找 D、活泼金属和活泼非金属区中寻找8. 下列物质中,属于共价化合物的是( )A、氯化镁 B、二氧化碳 C、氢气 D、硫酸铜9. 下列电子式的书写正确的是( )A、Mg2+ B、S2﹣ C、 D、
D、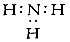 10. 山西被称为煤海,欲提高煤的燃烧效率,下列说法正确的是( )A、将煤粉碎后燃烧 B、通入大量的空气 C、加入的煤越多越好 D、将煤和空气在密闭的空间里燃烧11. 下列互为同位素的是( )A、Na 和 Na+ B、H2和 D2 C、16O 和 18O D、CO 和 CO212. 下列反应中,不属于可逆反应的是( )A、2NO2=N2O4与N2O4=2NO2 B、H2+I2 2HI与2HI H2+I2 C、CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O D、CaO+CO2=CaCO3与CaCO3 CaO+CO2↑13. 如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( )
10. 山西被称为煤海,欲提高煤的燃烧效率,下列说法正确的是( )A、将煤粉碎后燃烧 B、通入大量的空气 C、加入的煤越多越好 D、将煤和空气在密闭的空间里燃烧11. 下列互为同位素的是( )A、Na 和 Na+ B、H2和 D2 C、16O 和 18O D、CO 和 CO212. 下列反应中,不属于可逆反应的是( )A、2NO2=N2O4与N2O4=2NO2 B、H2+I2 2HI与2HI H2+I2 C、CO2+H2O=H2CO3与 H2CO3=CO2↑+H2O D、CaO+CO2=CaCO3与CaCO3 CaO+CO2↑13. 如图,将锌片和铜片用导线连接后放入稀硫酸中,下列有关说法中正确的是( ) A、铜片为电池的负极 B、SO42﹣向负极移动 C、电子从铜片流向锌片 D、铜片上发生的电极反应为Cu﹣2e﹣═Cu2+14. Al(OH)3 是一种常用的阻燃剂,添加在可燃物中的 Al(OH)3 受热分解的化学反应如下:2Al(OH)3 Al2O3+3H2O,其阻燃原因之一是此过程可以降温到可燃物的着火点以下.该反应属于( )A、离子反应 B、吸热反应 C、复分解反应 D、氧化还原反应15. 下列表示的是化学反应 A+2B═C+D 在不同条件下的反应速率,其中最快的是( )A、v(A)=0.3mol∙L﹣1∙s﹣1 B、v(B)=0.5mol∙L﹣1∙s﹣1 C、v(C)=0.25mol∙L﹣1∙s﹣1 D、v(D)=0.2mol∙L﹣1∙s﹣116. 下列各组递变情况描述错误的是( )A、H、Be、B 原子最外层电子数依次增多 B、P、S、Cl 元素最高正化合价依次升高 C、F2、Cl2、Br2、I2的熔点依次降低 D、Li、Na、K、Rb的金属性依次增强17. 2015年2月,科学家首次观测到化学键的形成.下列粒子之间存在化学键的是( )A、质子与电子之间 B、水分子与水分子之间 C、氧分子中氧原子与氧原子之间 D、氯化钠中钠离子与钠离子之间18. 复印机工作时,空气中的氧气可以转化为臭氧:3O2═2O3 , 下列有关说法正确的是( )A、该变化属于物理变化 B、1mol 臭氧比 1mol 氧气的能量高 C、空气中臭氧比氧气更稳定 D、氧分子中的化学键断裂会放出能量19. 下列有关离子键与共价键的说法中,正确的是( )A、共价化合物中一定没有离子键 B、单质中一定没有离子键,一定有共价键 C、共价键通过原子之间得失电子形成 D、非金属元素组成的化合物中不可能有离子键20. A,B,C,D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( )
A、铜片为电池的负极 B、SO42﹣向负极移动 C、电子从铜片流向锌片 D、铜片上发生的电极反应为Cu﹣2e﹣═Cu2+14. Al(OH)3 是一种常用的阻燃剂,添加在可燃物中的 Al(OH)3 受热分解的化学反应如下:2Al(OH)3 Al2O3+3H2O,其阻燃原因之一是此过程可以降温到可燃物的着火点以下.该反应属于( )A、离子反应 B、吸热反应 C、复分解反应 D、氧化还原反应15. 下列表示的是化学反应 A+2B═C+D 在不同条件下的反应速率,其中最快的是( )A、v(A)=0.3mol∙L﹣1∙s﹣1 B、v(B)=0.5mol∙L﹣1∙s﹣1 C、v(C)=0.25mol∙L﹣1∙s﹣1 D、v(D)=0.2mol∙L﹣1∙s﹣116. 下列各组递变情况描述错误的是( )A、H、Be、B 原子最外层电子数依次增多 B、P、S、Cl 元素最高正化合价依次升高 C、F2、Cl2、Br2、I2的熔点依次降低 D、Li、Na、K、Rb的金属性依次增强17. 2015年2月,科学家首次观测到化学键的形成.下列粒子之间存在化学键的是( )A、质子与电子之间 B、水分子与水分子之间 C、氧分子中氧原子与氧原子之间 D、氯化钠中钠离子与钠离子之间18. 复印机工作时,空气中的氧气可以转化为臭氧:3O2═2O3 , 下列有关说法正确的是( )A、该变化属于物理变化 B、1mol 臭氧比 1mol 氧气的能量高 C、空气中臭氧比氧气更稳定 D、氧分子中的化学键断裂会放出能量19. 下列有关离子键与共价键的说法中,正确的是( )A、共价化合物中一定没有离子键 B、单质中一定没有离子键,一定有共价键 C、共价键通过原子之间得失电子形成 D、非金属元素组成的化合物中不可能有离子键20. A,B,C,D四种短周期元素在周期表中的位置如图所示,其中C的原子序数是D的原子序数的2倍.下列有关说法正确的是( ) A、B 的M层电子数是K层的3倍 B、C 的离子具有与 Na+相同的电子层结构 C、A 与 D 形成的化合物属于离子化合物 D、C 的简单阴离子比 D 的简单阴离子还原性强
A、B 的M层电子数是K层的3倍 B、C 的离子具有与 Na+相同的电子层结构 C、A 与 D 形成的化合物属于离子化合物 D、C 的简单阴离子比 D 的简单阴离子还原性强二、必做题
-
21. 山西是我国重要的能源、化工基地,也是卫星发射基地.请回答下列问题.(1)、目前我省居民使用的主要能源有①煤②石油③风能④天然气⑤电能等,其中属于可再生能源的是(填序号),请再举出我省居民生活中的一种可再生能源 .(2)、天然气不仅可以用来直接燃烧提供能量,还是重要的化工原料.天然气的主要成分是 , 它可以与水在高温条件下反应制得水煤气(CO和H2),反应的化学方程式是 , 此时得到的水煤气中 CO和 H2的质量比是 .(3)、火箭可将卫星送入太空.火箭推进器中的强还原剂液态肼(N2H4)和强氧化剂混合时,发生反应 N2H4+2X═N2+4H2O,瞬间产生大量气体,推动火箭前进.由此判断X的化学式是 , 该反应为放热反应,反应物的总能量生成物总能量(填“高于”、“低于”或“等于”).22. 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.

请回答下列问题.
(1)、电池是将化学能直接转化为能的装置.(2)、氢氧燃料电池中发生反应的化学方程式是 . 作为碱性氢氧燃料电池,该电池的电解质溶液可以是 .(3)、b 电极上的反应为,则该电极为电池的极.从氧化还原角度分析,该反应属于反应.(4)、氢氧燃料电池与普通电池相比,其优点是(答出一点即可).但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是 .23. 一定条件下,向2L恒容密闭容器中充入1mol PCl5 , 发生反应:PCl5(g)⇌PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变):
t/s
0
30
150
250
350
450
n(PCl3)/mol
0
0.16
0.19
0.2
0.2
x
请回答下列问题:
(1)、x 的值是;(2)、0﹣50s 内,用PCl3的浓度变化表示的化学反应速率是;(3)、250s 以后,Cl2的物质的量不再改变的原因是;(4)、250s 时,容器中Cl2的物质的量是 , PCl5的物质的量是 , PCl5的转化率是 .24. 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
请回答下列问题.
(1)、铁与稀硫酸反应的离子方程式是 .(2)、适当升高烧瓶内液体的温度,产生气泡的速率将(填“加快、”“减慢”或“不变”),由此得出的结论是 .(3)、将稀硫酸换为浓硫酸,可观察到 , 原因是 .(4)、向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快.这是什么原因?甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用.
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快.
你同意的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量 , 观察现象.
25. 同学们为探究卤素单质氧化性的强弱,进行了以下实验.请填写下列空白.(1)、实验一:向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置.观察到液体分为两层,下层呈色.有关反应的化学方程式是 , 其中的氧化剂是 .(2)、实验二:向盛有少量碘化钠的试管中滴加少量 , 振荡,再加入四氯化碳,振荡后静置.观察到液体分为两层,下层呈色.由此得出的结论是 .(3)、综合以上两个实验,最终得出的结论是 .(4)、小明提出可将氟气通入氯化钠溶液中,若观察到有气泡冒出,即可证明氟气得氧化性强于氯气.同学们认为此方案不行,理由是 .26. 表为元素周期表的一部分.碳
氮
Y
X
硫
Z
请判断 X、Y、Z,并用相应的元素符号回答下列问题.
(1)、X是 , 它的原子M层电子数是 .(2)、表中元素原子半径最大的是 .(3)、Y在元素周期表中的位置是第周期第族,用电子式表示Y的最简单氢化物的形成过程 .(4)、氮气中氮原子之间的化学键属于键,由氮气与氢气反应生成1mol氨气时转移电子的数目是NA .(5)、硫与Z两种元素相比,非金属性强的是 , 请用化学方程式说明这一结论 .(6)、碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是 . 由最高价碳元素与最低价氮元素组成化合物的化学式是 .27. 已知在25℃,101kPa下,16g气态CH4充分燃烧生成液态水时放出890kJ热量.请计算:(1)、112LCH4(标准状况)在25℃,101kPa下,充分燃烧生成液态水时放出的热量;(2)、上述过程中同时产生二氧化碳的体积(标准状况).28. 短周期元素W、X、Y、Z分别属于三个周期,其原子序数依次增大,Y的原子半径是短周期主族元素中最大的.由W、X、Y、Z组成的物质之间存在下图所示的转化关系,其中m是元素Y的单质,n是元素Z的单质,通常为黄绿色气体,s的水溶液常用作漂白剂和消毒剂.
请回答下列问题:
(1)、Y的元素符号是 . 常温时Z的最高价氧化物对应水化物的水溶液pH7(填 大于、小于或等于).(2)、X的元素符号是 , 它位于元素周期表中第周期第族,它与同主族相邻元素相比,非金性更强的是 , 能说明这一强弱关系的事实是 .(3)、r的化学式是 , p中存在的化学键类型是 . 用电子式表示q的形成过程 .(4)、n与p反应的化学方程式是 , 该反应中2mol n完全反应时转移电子的数目是NA .29. 烟气中的氮氧化物(NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气污染.在25℃,101kPa下,1molO3与烟气中的NO完全反应生成NO2 , 同时放热317.3kJ.请计算:(1)、标准状况下,1m3烟气中含NO 0.224L,要处理3m3烟气中的NO,需O3的体积.(2)、上述 O3与NO在25℃,101kPa下,完全反应时产生的热量.