2016-2017学年山东省德州市夏津一中高一下学期期中化学试卷
试卷更新日期:2017-07-20 类型:期中考试
一、选择题
-
1. 下列各组物质,不能按图(“→”表示反应一步完成)关系转化的是( )
选项
a
b
c

A
Cu
CuO
Cu(OH)2
B
SiO2
Na2SiO3
H2SiO3
C
AlCl3
NaAlO2
Al(OH)3
D
CaO
Ca(OH)2
CaCO3
A、A B、B C、C D、D2. 下列复合材料对应的性能正确的是( )序号
复合材料
可能的性能
A
金属;C
强度高,抗冲击,绝缘性好,耐热温度低于300℃
B
陶瓷;SiO2
耐1600℃以上高温,强度高,密度小
C
合成树脂;SiO2 , Al2O3 , MgO
耐酸碱,化学稳定性好,强度高,密度小,韧性好
D
合成树脂;C
耐高温,强度高,导电性好,导热性好
A、A B、B C、C D、D3. 如下性质的递变中,不正确的是( )A、HCl、H2S、PH3的稳定性依次减弱 B、HClO4、H2SO4、H3PO4、H4SiO4的酸性依次减弱(相同条件下) C、CsOH、KOH、LiOH的碱性依次减弱 D、Na+、Mg2+、Al3+的氧化性依次减弱4. 在化学变化过程中,原子中的下列粒子数可能发生改变的是( )A、质子数 B、中子数 C、质量数 D、电子数5. X、Y、Z是短周期的三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为16,原子序数之和为38,则X、Y、Z的元素符号为( )A、Na、K、Ca B、N、P、S C、F、Cl、S D、O、S、Cl6. 几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )元素代号
A
B
D
E
G
H
I
J
化合价
﹣1
﹣2
+4、﹣4
﹣1
+5、﹣3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A、I在DB2中燃烧生成两种化合物 B、A、H、J的离子半径由大到小顺序是H>J>A C、G元素的单质不存在同素异形体 D、A单质能从B的氢化物中置换出B单质来7. 下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )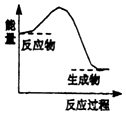 A、氢氧化钾与硫酸的反应 B、金属镁与盐酸的反应 C、高温条件下碳粉与二氧化碳的反应 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应8. 如图是周期表中短周期的一部分,A,B,C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
A、氢氧化钾与硫酸的反应 B、金属镁与盐酸的反应 C、高温条件下碳粉与二氧化碳的反应 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应8. 如图是周期表中短周期的一部分,A,B,C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )A
C
B
A、三种元素的原子半径的大小顺序是:B>C>A B、A元素最高价氧化物对应的水化物具有强氧化性 C、B元素的氧化物、氢化物的水溶液都呈酸性 D、C元素是非金属性最强的元素9. 某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述不正确的是( )A、R的气态氢化物为H2R B、R的最高价氧化物的水化物为H2RO4 C、R一定是第IVA族元素 D、R的最高价氧化物为RO310. 一定条件下的可逆反应2NO2 (红棕色)⇌2NO (无色)+O2 (无色),在恒压密闭容器充入NO2 , 达到化学平衡状态的标志是( )A、反应停止了 B、NO的正反应速率与O2的逆反应速率相等 C、c(NO):c(O2)=2:1 D、气体的颜色不再变化11. 用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;
②加入少量NaNO3固体;
③加入少量CuSO4固体;
④加入少量CH3COONa固体;
⑤加热;
⑥将稀硫酸换成98%硫酸,
其中可增大单位时间内氢气收集量的措施有( )
A、①③④ B、①③⑤ C、②④⑤ D、②⑤⑥12. 在2A(g)+B(g)═3C(g)+4D(g)反应中,表示该反应速率最快的是( )A、vA=0.5mol•L﹣1•s﹣1 B、vB=0.3 mol•L﹣1•s﹣1 C、vC=0.8 mol•L﹣1•s﹣1 D、vD=1.0 mol•L﹣1•s﹣113. 下列事实不能作为实验判断依据的是( )A、钠和镁分别与冷水反应,判断金属活动性强弱 B、铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 C、酸性H2CO3<H2SO4 , 判断硫与碳的非金属活动性强弱 D、Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱14. 理论上不能设计为原电池的化学反应是( )A、CH4(g)+2O2(g)═CO2(g)+2H2O(l) B、HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) C、2H2(g)+O2(g)═2H2O(l) D、2FeCl3(aq)+Fe(s)═3FeCl3(aq)15. 分子式为C4H8Cl2的同分异构体共有(不考虑立体异构)( )A、10种 B、9种 C、8种 D、7种16. 将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示.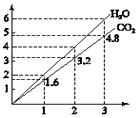
①一定有C2H4
②一定有CH4
③一定有C3H8
④一定没有C2H6
⑤可能有C2H2
则上述对该混合烃的判断正确的是( )
A、②③⑤ B、⑤⑥ C、②④⑥ D、①④二、非选择题
-
17. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物.(1)、写出Y2O2的电子式: , 其中含有的化学键是 .(2)、Z元素在周期表中的位置是第周期、第族.X和Z形成的一种二元化合物具有温室效应,其相对分子质量在170~190之间,且Z的质量分数约为70%.该化合物的化学式为 .(3)、X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(填化学式).(4)、XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是(填化学式).(5)、由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式 .18. 为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计了如下实验.注意:设计实验时,必须控制只有一个变量!
试剂:4% H2O2溶液,12% H2O2溶液,1mol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
(1)、实验1:实验目的:温度对化学反应速率的影响实验步骤:分别向甲、乙两支试管中加入5mL4% H2O2溶液,再分别加入3滴1mol/LFeCl3溶液,待两支试管中均有适量气泡出现时,将试管甲放入5℃水浴中,将试管乙放入40℃水浴中.实验现象:试管(填甲或乙)中产生气泡的速率快,说明 .
(2)、实验2:实验目的:浓度对化学反应速率的影响实验步骤:向试管甲中加入5mL4% H2O2溶液,向试管乙中加入5mL12%H2O2溶液.
实验现象:试管甲、乙中均有少量气体缓慢产生.
该实验现象不明显,你如何改进实验方案,使实验现象支持“浓度改变会影响化学反应速率”这一理论预测 .
(3)、实验3:实验目的: .实验步骤:在试管甲中加入5mL4% H2O2溶液,在试管乙中加入5mL4% H2O2溶液再加入1mL 1moLFeCl3溶液.
你认为方案3的设计是否严谨?(填是或否),说明理由 .
19. 某学习小组同学利用如图装置来验证同主族元素非金属性的变化规律: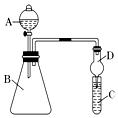 (1)、要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.干燥管D的作用是 . 从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用溶液吸收尾气.(2)、要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3 , C中加Na2SiO3溶液,将观察到C中的现象.但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 . 因此应在B、D之间增加一个盛有足量(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是 .20. 如图是实验室制备四氯化硅液体的装置.已知:四氯化硅熔点为﹣70℃,沸点57.6℃,遇水极易反应.
(1)、要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.干燥管D的作用是 . 从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用溶液吸收尾气.(2)、要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3 , C中加Na2SiO3溶液,将观察到C中的现象.但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由 . 因此应在B、D之间增加一个盛有足量(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是 .20. 如图是实验室制备四氯化硅液体的装置.已知:四氯化硅熔点为﹣70℃,沸点57.6℃,遇水极易反应.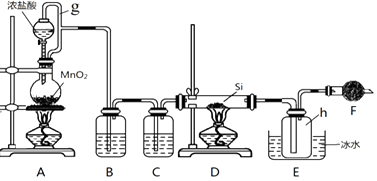
请回答下列问题.
(1)、写出装置A中发生反应的化学方程式(2)、装置B中盛放的试剂是;装置C的作用是(3)、g管的作用是(4)、装置E中冰水的作用是(5)、干燥管F中碱石灰的作用是和(6)、若要用装置B、C代替装置F,则装置B、C中应盛放的试剂分别是、 .21. 以冶铝的废弃物灰为原料制取超细α﹣氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:图1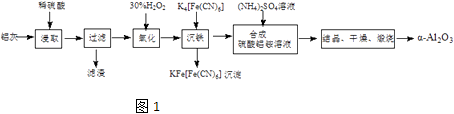 (1)、铝灰中氧化铝与硫酸反应的化学方程式为 .(2)、图中“滤渣”的主要成分为 (填化学式).(3)、加30%的H2O2溶液发生的离子反应方程式为 .(4)、煅烧硫酸铝铵晶体,发生的主要反应为:
(1)、铝灰中氧化铝与硫酸反应的化学方程式为 .(2)、图中“滤渣”的主要成分为 (填化学式).(3)、加30%的H2O2溶液发生的离子反应方程式为 .(4)、煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2•12H2O] 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过图2所示的装置.

①集气瓶中收集到的气体是(填化学式).
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有(填化学式).
③KMnO4溶液褪色(MnO4﹣还原为Mn2+),发生的离子反应方程式为 .