2016-2017学年山东省德州市武城二中高一下学期期中化学试卷(普通班)
试卷更新日期:2017-07-20 类型:期中考试
一、选择题
-
1. 下列叙述正确的是( )A、道尔顿发现了元素周期律,制订了第一张科学的元素周期表 B、短周期中包含了18种原子 C、元素的性质呈现周期性变化的根本原因是核外电子排布的周期性变化 D、周期表中所有元素,都是从自然界中发现的2. Al、Fe、Cu都是重要的金属元素,下列说法正确的是( )A、三者对应的氧化物均为碱性氧化物 B、三者的单质放置在空气中均只生成氧化物 C、Fe2O3与Fe3O4互为同素异形体 D、常温下三者加入浓硫酸中均无明显现象3. 下列表示物质或微粒的化学用语正确的是( )A、HF的电子式为
 B、Mg2+的结构示意图为
B、Mg2+的结构示意图为  C、CO2的电子式为:
C、CO2的电子式为:  D、Cl﹣的结构示意图为
D、Cl﹣的结构示意图为  4. 下列各组物质中,每种物质都既含离子键又含共价键的是( )A、Na2O2、CaCl2 B、CO2、CH4 C、NH4Cl、NaOH D、NaF、HNO35. 下列各组元素中,原子半径依次增大的是( )A、I、Br、Cl B、Al、Si、P C、O、S、Na D、C、N、B6. 下列说法正确的是( )A、含有共价键的化合物一定是共价化合物 B、在共价化合物中一定含有共价键 C、离子化合物中只含有离子键 D、化学键断裂的变化一定是化学变化7. 已知反应2SO2(g)+O2(g)⇌2SO3(g),一定条件下发生反应生成2molSO3 , 放出热量为197KJ.若在相同条件下,向密闭容器中通入2mol SO2和1molO2 , 反应达到平衡时放出热量Q,则下列关系式正确的是( )A、Q=197KJ B、Q<197×2 KJ C、Q<197KJ D、Q>197KJ8. 下列各组的电极材料和电解液,不能组成原电池的是( )A、铜片、石墨棒,乙醇 B、铜片、石墨棒,硝酸银溶液 C、锌片、铜片,稀盐酸 D、铜片、铂片,FeCl3溶液9. 下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
4. 下列各组物质中,每种物质都既含离子键又含共价键的是( )A、Na2O2、CaCl2 B、CO2、CH4 C、NH4Cl、NaOH D、NaF、HNO35. 下列各组元素中,原子半径依次增大的是( )A、I、Br、Cl B、Al、Si、P C、O、S、Na D、C、N、B6. 下列说法正确的是( )A、含有共价键的化合物一定是共价化合物 B、在共价化合物中一定含有共价键 C、离子化合物中只含有离子键 D、化学键断裂的变化一定是化学变化7. 已知反应2SO2(g)+O2(g)⇌2SO3(g),一定条件下发生反应生成2molSO3 , 放出热量为197KJ.若在相同条件下,向密闭容器中通入2mol SO2和1molO2 , 反应达到平衡时放出热量Q,则下列关系式正确的是( )A、Q=197KJ B、Q<197×2 KJ C、Q<197KJ D、Q>197KJ8. 下列各组的电极材料和电解液,不能组成原电池的是( )A、铜片、石墨棒,乙醇 B、铜片、石墨棒,硝酸银溶液 C、锌片、铜片,稀盐酸 D、铜片、铂片,FeCl3溶液9. 下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )选项
叙述Ⅰ
叙述Ⅱ
A
同主族元素的最外层电子数相同
同主族元素的化学性质一定相似
B
原电池可将化学能转化为电能
原电池需外接电源才能工作
C
S的非金属性比Si强
酸性:H2SO4>H4SiO4
D
Na在Cl2中燃烧的生成物含离子键
NaCl固体可导电
A、A B、B C、C D、D10. 下列反应能设计成原电池的是( )A、Ba(OH)2•8H2O与NH4Cl反应 B、石灰石分解反应 C、NaOH溶液与盐酸反应 D、甲烷与O2的反应11. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、2.0 g H218O与D2O的混合物中所含中子数为NA B、2.8gN2和CO的混合气体中所含质子数为1.4NA C、过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA D、50mL12mol/L﹣1盐酸与足量MnO2共热,转移的电子数为0.3NA12. A,B,C三种短周期元素在元素周期表中的位置如图所示,已知A,C元素可分别与B元素形成化合物X和Y,A与B的质子数之和等于C的质子数.现有以下说法,其中判断正确的组合是( )A
B
C
①B与C均存在同素异形体
②X的种类比Y的多
③沸点:A的最简单氢化物低于C的最简单氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐.
A、①②③④ B、②③ C、①②④ D、①④13. 温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
A、把铁块变成铁粉 B、将容器的体积缩小一半 C、压强不变,充入氮气使容器体积增大 D、体积不变,充入氮气使容器压强增大14. 某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
实验
记录
①Zn质量减少,Cu质量不变;
②外电路电流方向是:由Cu→Zn;
③SO42﹣ 向Cu极移动;
④Zn电极发生氧化反应;
⑤正极反应式:Cu2++2e﹣═Cu
A、①②④ B、②③④ C、②④⑤ D、①③⑤15. 有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )A、若HnXOm为强酸,则X的氢化物溶于水一定显酸性 B、若X(OH)n为强碱,则Y(OH)n也一定为强碱 C、若X元素形成的单质是X2 , 则Y元素形成的单质也一定是Y2 D、若Y的最高正化合价为+m,则X的最高正化合价一定为+m16. 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )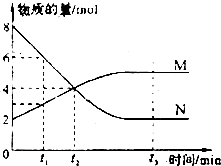 A、t3时,正反应速率大于逆反应速率 B、t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 C、化学方程式为:2M=N D、t1时,N的浓度是M浓度的2倍
A、t3时,正反应速率大于逆反应速率 B、t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 C、化学方程式为:2M=N D、t1时,N的浓度是M浓度的2倍二、非选择题
-
17. 某小组同学在烧杯中加入5mL1.0mol•L﹣1盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是(填“吸热”或“放热”)反应,其能量变化可用图中的(填“B”或“C”)表示.
 18. 已知拆1molH﹣H键、1molN≡N、1molN﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ.则由N2和H2反应生成1molNH3 需要(填“放出”或“吸收”)的热量.19. 欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为 , 电解质溶液为 , 10min内该电池向外提供0.2mol电子,负极材料的质量变化为 , 假设该电解质溶液为1L,则以Fe3+浓度变化表示的该反应的速率为 .20. 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
18. 已知拆1molH﹣H键、1molN≡N、1molN﹣H键分别需要吸收的能量为436kJ、946kJ、391kJ.则由N2和H2反应生成1molNH3 需要(填“放出”或“吸收”)的热量.19. 欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为 , 电解质溶液为 , 10min内该电池向外提供0.2mol电子,负极材料的质量变化为 , 假设该电解质溶液为1L,则以Fe3+浓度变化表示的该反应的速率为 .20. 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.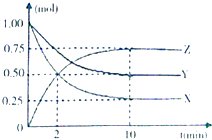
根据图中数据,完成下列问题:
(1)、该反应的化学方程;(2)、反应开始至2min,气体Z的平均反应速率为;(3)、若X、Y、Z均为气体,则反应起始时与平衡后的压强之比是 .(4)、达到平衡后,下列说法不正确的是A、X、Y、Z的浓度之比是1:2:3 B、X的消耗速率和Y的生成速率相等 C、Z的浓度保持不变 D、升高温度重新达到平衡,Z的浓度减小,则该反应为吸热反应.21. X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应.请回答下列问题:
(1)、T元素在期表中的位置是;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为(写出其中一种物质的名称).(2)、X、Z、Q三种元素的原子半径由小到大顺序为(填元素符号).(3)、T、U两元素最高价氧化物对应的水化物反应的离子方程式为 .(4)、下列可以判断R和T金属性强弱的是(填序号).a.单质的熔点R比T低
b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈
d.最高价氧化物的水化物的碱性R比T强
(5)、某同学用Q、R两元素的单质反应生成固体物质R2Q2 , R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为;R2Q2与X2Q反应的化学方程式为 .22. 某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的试验. (1)、A装置中反应的离子方程式为;B装置采用水浴加热的优点是 .(2)、制取实验结束后,取出B中试管冷却结晶,过滤、洗涤.该实验操作过程需要的玻璃仪器有 .(3)、若对调B和C装置的位置,(填“能”或“不能”)提高B中氯酸钾的产率.(4)、验证非金属性Cl>I的实验现象是 . 该装置(填“能”或“不能”)验证非金属性Cl>Br>I.(5)、利用如图2装置验证非金属性:C>Si,B中加Na2CO3 , C中加Na2SiO3溶液,A中应该加入 , C中反应的化学方程式 .
(1)、A装置中反应的离子方程式为;B装置采用水浴加热的优点是 .(2)、制取实验结束后,取出B中试管冷却结晶,过滤、洗涤.该实验操作过程需要的玻璃仪器有 .(3)、若对调B和C装置的位置,(填“能”或“不能”)提高B中氯酸钾的产率.(4)、验证非金属性Cl>I的实验现象是 . 该装置(填“能”或“不能”)验证非金属性Cl>Br>I.(5)、利用如图2装置验证非金属性:C>Si,B中加Na2CO3 , C中加Na2SiO3溶液,A中应该加入 , C中反应的化学方程式 .