初中化学人教版九年级下学期 第八单元测试卷
试卷更新日期:2019-11-26 类型:单元试卷
一、单选题
-
1. “垃圾是放错了位置的资源”,应分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线等,可以归为一类加以回收,它们属于( )A、氧化物 B、金属或合金 C、盐 D、碱2. 下列措施中,不能防止金属制品锈蚀的是()A、在表面刷漆 B、在表面涂油 C、在表面镀铬 D、用湿布擦拭3. 金属M与Cu(NO3)2溶液发生反应:M+Cu(NO3)2=Cu+M(NO3)2 , 下列叙述错误的是( )A、金属M不可能是铝 B、M一定发生反应:M+2AgNO3=2Ag+M(NO3)2 C、若M为镁,恰好完全反应后,溶液质量较反应前减少 D、恰好完全反应后,M表面有红色固体析出,溶液一定由蓝色变为无色4. 一定质量的Zn加入到含有Fe(NO3)2和AgNO3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )
①滤液中一定有Zn2+、Fe2+
②滤液中可能有Ag+
③滤渣中一定有Ag,可能有Fe
A、①② B、①③ C、②③ D、①②③5. 为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行下面的四组实验,一段时间后只在实验I中观察到了红褐色的锈斑,其他均无明显变化。下列说法错误的是( )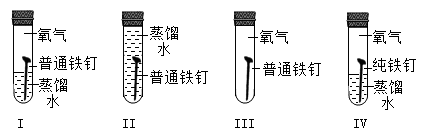 A、I和Ⅱ说明铁制品锈蚀需要O2 B、I和Ⅲ说明铁制品锈蚀需要H2O C、I和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀 D、Ⅲ和Ⅳ说明铁制品的锈蚀与铁制品内部结构有关6. 现有X、Y、Z三种金属,已知:①X+YCl2=XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有Y和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )A、X>Z>Y B、Z>Y>X C、Y>Z>X D、X>Y>Z7. 已知化学反应:X+YSO4=Y+XSO4 , 根据此反应信息判断正确的是()A、X一定是金属铁 B、Y一定是金属铜 C、X的金属活动性比Y强 D、Y的金属活动性比X强8. 如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
A、I和Ⅱ说明铁制品锈蚀需要O2 B、I和Ⅲ说明铁制品锈蚀需要H2O C、I和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀 D、Ⅲ和Ⅳ说明铁制品的锈蚀与铁制品内部结构有关6. 现有X、Y、Z三种金属,已知:①X+YCl2=XCl2+Y,②把Y、Z两种金属分别放入稀硫酸中,只有Y和稀硫酸反应。这三种金属的活动性由强到弱的顺序是( )A、X>Z>Y B、Z>Y>X C、Y>Z>X D、X>Y>Z7. 已知化学反应:X+YSO4=Y+XSO4 , 根据此反应信息判断正确的是()A、X一定是金属铁 B、Y一定是金属铜 C、X的金属活动性比Y强 D、Y的金属活动性比X强8. 如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A、①② B、②④ C、②③ D、③④9. 由两种金属组成的混合物共20g,与足量的盐酸充分反应后,共生成1g氢气,则原混合物的组成不可能是()A、Zn和Mg B、Fe和Mg C、Zn和Fe D、Mg和Cu10. 下列反应属于置换反应的是()A、3Fe+2O2 Fe3O4 B、CaCO3 CaO+CO2↑ C、2KMnO4 K2MnO4+MnO2+O2↑ D、Cl2+2KI=2KCl+I211. 已知铜能与氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2 . 将一定质量的氧化铁与铜的混合物固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后过滤,得到固体甲和滤液乙。取适量滤液乙于试管中,加入一定质量的锌粉,充分反应,得到固体丙和滤液丁。下列有关说法中:①固体甲中一定含Cu,一定不含Fe2O3
②滤液乙中一定含有FeCl2、CuCl2 , 一定不含FeCl3
③向溶液丁中插入一根铁丝,若铁丝表面有红色物质析出,则滤液丁中一定有ZnCl2、FeCl2
④若向固体丙加稀盐酸有气体产生,则滤液丁中可能含有ZnCl2、FeCl2 , 一定不含有CuCl2
⑤固体丙中最多可能含有3种物质
⑥若向固体丙加稀盐酸无明显现象,则滤液丁中一定含有ZnCl2、FeCl2 , 可能含有CuCl2
其中正确的个数有()
A、2个 B、3个 C、4个 D、5个12. 小明将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内压强和反应时间的变化曲线如图所示,下列分析正确的是()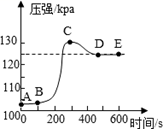 A、AB段表示铝与盐酸反应 B、CD段压强变化的主要影响因素是温度 C、C点生成的氢气质量大于D点 D、D点处反应刚好结束
A、AB段表示铝与盐酸反应 B、CD段压强变化的主要影响因素是温度 C、C点生成的氢气质量大于D点 D、D点处反应刚好结束二、填空题
-
13. 按要求写化学方程式:(1)、北宋《浸铜要略序》记载:“山篥有胆泉(硫酸铜溶液)”,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜。”请用化学化学方程式表示其原理。(2)、铝的抗腐蚀性好的原因,用化学化学方程式表示其原理。14. 金属在生产生活中应用广泛。(1)、铝制成铝箔是利用了铝的性;铜制电源插头是利用了铜的性。(2)、铁质围栏喷上油漆能防锈的原理是 , 在围栏表面涂铝粉也可防锈,这是因为铝的性比铁强15. 人类的生活与生产都离不开金属和金属材料。(1)、铝的金属活动性比铁强,但为什么生活中常在铁制品表面涂刷铝粉来防止铁制品锈蚀?(2)、向某硝酸银、硝酸汞混合溶液中逐渐加入锌粉,溶液质量与加入锌粉的质量关系如图所示。
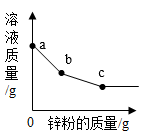
①写出a~b段发生反应的化学方程式:。
②写出c点时溶液中溶质的化学式:。
16. 金属材料在生产生活中十分广泛.(1)、根据如图金属应用实例推断,金属具有的物理性质有、 (2)、生铁和钢都是铁的合金,二者性能不同的原因是;(3)、写出工业上以赤铁矿为原料炼铁过程中,发生反应的化学方程式;每年因腐蚀而消费掉的金属材料数量惊人,铁生锈的条件是;防止金属腐蚀是保护金属资源的一条有效途径,保护金属资源的途径(答一条即可).
(2)、生铁和钢都是铁的合金,二者性能不同的原因是;(3)、写出工业上以赤铁矿为原料炼铁过程中,发生反应的化学方程式;每年因腐蚀而消费掉的金属材料数量惊人,铁生锈的条件是;防止金属腐蚀是保护金属资源的一条有效途径,保护金属资源的途径(答一条即可).三、实验探究题
-
17. 为验证铜、铁、锌三种金属的活动性顺序,甲同学与乙同学分别设计了不同的实验方案,都能达到实验目的。实验室可供选择的试剂有:锌片、铁片、铜片、硫酸锌溶液(无色)、硫酸亚铁溶液(浅绿色)、硫酸铜溶液(蓝色),实验方案如表:
实验方案
方案一
方案二
实验操作

一种金属放入两种溶液中

两种金属同时放入一种溶液中
(1)、方案一选择的金属;(2)、方案二中,当金属足量时,最终烧杯中液体呈色;(3)、其他同学设计了以下不同实验方案,其中同样可以达到实验目的有_____(填字母)A、取一定量硫酸锌溶液,分别加入铁片与铜片 B、取一定量硫酸铜溶液,加入足量铁片充分反应后取出铁片,再加入锌片 C、取一定量硫酸亚铁溶液,加入锌片,一段时间后把锌片表面新得物质加入一定量硫酸铜溶液中18. 铁合金是生产生活中使用最广泛的金属材料,但铁制品容易被腐蚀而在表面生成红褐色的铁锈。为探究铁制品锈蚀的条件,寻找防止铁制品锈蚀的方法,现进行如下实验:步骤1:利用右图所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,将导管a、b处的止水夹k1、k2夹紧。
步骤2:一段时间后,观察U形管内三处铁丝表面的变化情况。
回答下列问题:
 (1)、步骤1中,检验U形管内已充满O2的方法是。(2)、步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有(填化学式),②处可能观察到的现象是 , ③处没有明显变化,说明纯铁的抗腐蚀能力较(填“强”或“弱”)。(3)、待U形管内有明显现象后,将b导管插入水中,打开止水夹k2 , 观察到现象,说明该条件下铁制品锈蚀过程消耗了O2。(4)、通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁):。19. 某同学将如下实验一反应后的物质和实验二反应后的硬质玻璃管中的物质倒入同一个容器内,发现有化学反应发生,于是便对容器内反应后的物质成分探究产生了兴趣。
(1)、步骤1中,检验U形管内已充满O2的方法是。(2)、步骤2中,观察到①处没有明显变化,说明铁制品锈蚀的条件之一是需要有(填化学式),②处可能观察到的现象是 , ③处没有明显变化,说明纯铁的抗腐蚀能力较(填“强”或“弱”)。(3)、待U形管内有明显现象后,将b导管插入水中,打开止水夹k2 , 观察到现象,说明该条件下铁制品锈蚀过程消耗了O2。(4)、通过上述实验现象,请你提出一种防止铁制品锈蚀的方法(不包括制造纯铁):。19. 某同学将如下实验一反应后的物质和实验二反应后的硬质玻璃管中的物质倒入同一个容器内,发现有化学反应发生,于是便对容器内反应后的物质成分探究产生了兴趣。(查阅资料):Fe2O3+6HCl=2FeCl3+3H2O
实验一

实验二
 (1)、(讨论分析)同学们经过讨论分析,认定该容器内物质混合后会发生化学反应,化学方程式为.(2)、(设计实验)为进一步确定容器内物质成分,同学们做了以下探究,请完成填空。
(1)、(讨论分析)同学们经过讨论分析,认定该容器内物质混合后会发生化学反应,化学方程式为.(2)、(设计实验)为进一步确定容器内物质成分,同学们做了以下探究,请完成填空。实验步骤
实验现象
实验结论
一、把容器内的混合物过滤,得到固体和溶液,将固体烘干,用磁铁吸引固体。
固体中不含铁。
二、取少量步骤一固体,加入过。
固体粉末减少,溶液变成黄色
固体中一定含有。
三、
溶液中含有硝酸铜
(问题探讨)混合物中不含单质铁的原因是。
四、推断题
-
20. A~K是同学们已学过的初中化学常见的物质,它们之间的转化关系如下图所示(部分反应条件已略去),其中E是世界上年产量最大的金属,A和H的组成元素相同。请回答下列问题:
 (1)、物质J的用途之一为。(2)、反应③基本反应类型为。(3)、反应①在实际中的应用为。(4)、反应④属于基本反应类型,其化学方程式为。
(1)、物质J的用途之一为。(2)、反应③基本反应类型为。(3)、反应①在实际中的应用为。(4)、反应④属于基本反应类型,其化学方程式为。五、计算题