初中化学人教版九年级下学期 第八单元课题3 金属资源的利用和保护
试卷更新日期:2019-11-26 类型:同步测试
一、单选题
-
1. 地壳中含量最多的元素是( )A、氮 B、铝 C、硅 D、氧2. 探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
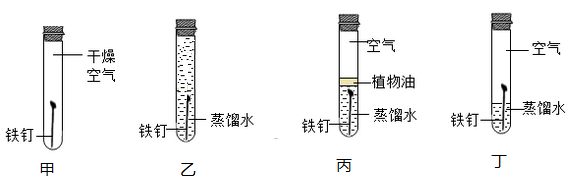 A、甲和乙:水 B、乙和丙:空气 C、甲和丙:空气 D、甲和丁:水3. 下列有关金属的说法正确的是()A、钢的含碳量比生铁的含碳量高 B、防止金属锈蚀是保护金属资源的有效途径 C、镁带在空气中燃烧,发出耀眼白光,生成黑色固体 D、铝制品不需要涂保护层来防腐蚀,因为常温下铝不与氧气反应4. 下列措施中,不能防止金属制品锈蚀的是()A、在表面刷漆 B、在表面涂油 C、在表面镀铬 D、用湿布擦拭5. 用“W”型玻璃管进行微型实验,如图所示。下列说法错误的是()
A、甲和乙:水 B、乙和丙:空气 C、甲和丙:空气 D、甲和丁:水3. 下列有关金属的说法正确的是()A、钢的含碳量比生铁的含碳量高 B、防止金属锈蚀是保护金属资源的有效途径 C、镁带在空气中燃烧,发出耀眼白光,生成黑色固体 D、铝制品不需要涂保护层来防腐蚀,因为常温下铝不与氧气反应4. 下列措施中,不能防止金属制品锈蚀的是()A、在表面刷漆 B、在表面涂油 C、在表面镀铬 D、用湿布擦拭5. 用“W”型玻璃管进行微型实验,如图所示。下列说法错误的是() A、a处红棕色粉末变为黑色 B、b处澄清石灰水变浑浊证明有CO2生成 C、a处的反应化学方程式为CO+Fe2O3=2Fe+CO2 D、可利用点燃的方法进行尾气处理6. 如图是探究铁生锈条件的装置,调节L端和R端的液面高度一致,塞紧活塞,一周之后,观察现象,下列推断错误的是( )
A、a处红棕色粉末变为黑色 B、b处澄清石灰水变浑浊证明有CO2生成 C、a处的反应化学方程式为CO+Fe2O3=2Fe+CO2 D、可利用点燃的方法进行尾气处理6. 如图是探究铁生锈条件的装置,调节L端和R端的液面高度一致,塞紧活塞,一周之后,观察现象,下列推断错误的是( ) A、a管中的铁钉不生锈 B、b管中的铁钉不生锈 C、一周后L端比R端液面高 D、把水换成食盐水,铁生锈会更快
A、a管中的铁钉不生锈 B、b管中的铁钉不生锈 C、一周后L端比R端液面高 D、把水换成食盐水,铁生锈会更快二、实验探究题
-
7. 金属的开发和利用是人类文明和社会进步的标志,随着科学技术的发展,人类获取金的方式也变得多样化

 (1)、(一)获取金属
(1)、(一)获取金属铁是冶炼最多的金属,工业上是采用高炉炼铁,而在实验室里采用如图1,写出如图的化学方程式。
(2)、实验中观察到A装置中的现象为。(3)、装置B的作用有(填序号)①处理尾气一氧化碳 ②检验二氧化碳 ③吸收部分二氧化碳
(4)、(二)金属的应用共享汽车越来越方便我们的出行,但是长期暴露在室外也会减短使用寿命,如图是某厂利用来自于共享电汽车的合金废料(含Fe、Cu和Al)制取FeSO4和CuSO4溶液的流程示意图(如图2部分生成物已略):
步骤①反应的化学方程式为:2Al+2NaOH+2R=2NaAlO2+3H2↑,R的化学式为。
(5)、合金属于(填“纯净物”或“混合物”);写出步骤②反应的化学反应方程式。(6)、由Cu制取CuSO4溶液有以下2种途径,请选择一种最佳途径,说明理由。I.Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
II.2Cu+O2 2CuO CuO+H2SO4=CuSO4+H2O
(7)、黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品取6.0g该铜锌合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,烧杯内剩余固体质量为4.7g。请计算:反应生成的氢气的质量为多少?8. 某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸,B中所盛放的试剂是浓硫酸,作用是除去气体中的水蒸气。(已知铁锈可以溶解在稀盐酸中) (1)、步骤一:关闭 和 ,打开 ,A中反应的化学方程式是对比铁丝表面的变化,能够说明铁生锈与水有关的是装置(填C、D或E,下同),能够说明铁生锈的快慢与反应物浓度有关的是装置。(2)、步骤二:关闭 ,打开 和 ,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,广口瓶D中的现象是。C中反应的化学方程式是。9. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。(1)、I.探究铜锈的组成
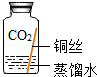
(1)、步骤一:关闭 和 ,打开 ,A中反应的化学方程式是对比铁丝表面的变化,能够说明铁生锈与水有关的是装置(填C、D或E,下同),能够说明铁生锈的快慢与反应物浓度有关的是装置。(2)、步骤二:关闭 ,打开 和 ,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,广口瓶D中的现象是。C中反应的化学方程式是。9. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。(1)、I.探究铜锈的组成(查阅资料)①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。

(解释与结论)C中反应的化学方程式是。
(2)、依据以上现象分析,铜锈中一定含有的元素:Cu和。(3)、II.探究铜生锈的条件(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号
①
②
③
④
⑤
实验




现象
无明显现象
无明显现象
铜丝表面
有绿色物质
无明显现象
无明显现象
(解释与结论)
实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
(4)、得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。(5)、对比实验②和③,得出的结论是。(6)、为验证猜想,请在图中将实验⑤补充完整。(7)、由上述实验可推知,铜生锈的条件是。(8)、结合上述实验,你对保存铜制品的建议是。三、综合题
-
10. 去年港珠澳大桥正式建成通车,它是世界上钢结构桥体最长的跨海大桥。请根据所学知识,回答有关金属资源的下列问题。(1)、在空气中,铁与同时接触发生反应而生锈;(2)、请写出一条防止铁生锈的措施;(3)、除防止金属腐蚀外,请写出还有哪些保护金属资源的有效途径。(答一点)11. 在人类社会的发展进程中,金属起着重要的作用。(1)、青铜是铜锡合金,其属于(填“金属材料”或“合成材料”)。(2)、某些铁制零件防锈措施是涂油,其防锈原理是。工人师傅常用稀盐酸除铁锈,其反应的化学方程式是。(3)、铝合金广泛应用于飞机制造业,可增加飞机的载重量以及提高运行速度,这是利用了铝合金(答一点即可)的优良性能。(4)、向硝酸银和硝酸铝的混合溶液中加入一定量的铁粉,观察到溶液由无色变为浅绿色后,对混合物进行过滤,则滤液中一定含有的溶质是。12. 阅读下列材料。
美丽富饶的云南被誉为“有色金属王国”,其中铝、锌、锡的保有储量居全国第一位,铜、镍的保有储量居全国第三位,是国家重要的锡、铜生产基地。
我国古代曾用“湿法炼铜”“火法炼铜”。“湿法炼铜”的原理是“曾青(硫酸铜溶液)得铁则化为铜”;“火法炼铜”中用辉铜矿(主要成分Cu2S)炼铜的原理是:Cu2S与氧气在高温条件下反应生成铜和一种会导致酸雨的气体(其相对分子质量为64)。
在河南安阳、湖北荆州、湖南宁乡、云南江川等地分别出土了后(司)母戊鼎、越王勾践剑、四羊方尊、牛虎铜案等青铜文物,充分反映出我国古代青铜器的高超熔铸技艺。青铜是铜锡合金,锡的加入明显提高了铜的强度,抗腐蚀性增强,因此锡青铜常用于制造齿轮等耐磨零部件和耐蚀配件。
虽然云南有色金属资源丰富,但是矿物的储量有限,而且不能再生,所以保护金属资源刻不容缓。
回答下列问题:
(1)、下列在云南出土的文物是______(填标号)。A、四羊方尊 B、牛虎铜案 C、越王勾践剑 D、后(司)母戊鼎(2)、可用来冶炼锡的矿石是______(填标号)。A、菱铁矿(主要成分FeCO3) B、铝土矿(主要成分Al2O3) C、锡石(主要成分SnO2) D、黄铜矿(主要成分CuFeS2)(3)、青铜的抗腐蚀性比纯铜的(填“强”或“弱”)。(4)、本材料中,“湿法炼铜”的化学方程式是 , “火法炼铜”的化学方程式是。13. 金属及金属材料在生产、生活中有广泛的应用。(1)、近年来,我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:
①图中标识的物质,属于金属材料的是(写出一种即可)。
②使用铝合金做内筒的优点是(写出一点即可)。某品牌饮料的空易拉罐应收入(填“可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的发生化学反应的过程;除去铁制品表面的铁锈可用稀盐酸,反应的化学方程式为。
(2)、将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象;若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是。(3)、将一定质量的铁粉加入到Al(NO3)3、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是_____(填字母)。A、若滤液为蓝色,则滤渣中一定有银,可能有铜 B、若滤渣中含有银、铜、铁,则滤液中一定含有Al3+、Fe3+、NO3﹣ C、若滤液为浅绿色,则滤渣中一定含银、铜、铝 D、若滤渣中加稀盐酸无气泡产生,则滤液中一定有Al3+、Fe2+、Cu2+ , 可能有Ag+四、计算题
-
14. 将Cu-Zn合金样品20g放入足量稀硫酸中,所产生氢气的质量与反应时间的关系如图所示.试计算:
 (1)、反应产生氢气的质量为g(2)、原样品中所含锌的质量分数 .(3)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶质的质量
(1)、反应产生氢气的质量为g(2)、原样品中所含锌的质量分数 .(3)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶质的质量