初中化学人教版九年级下学期 第八单元课题2 金属的化学性质
试卷更新日期:2019-11-26 类型:同步测试
一、单选题
-
1. 假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )A、硫酸亚铁溶液 B、稀盐酸 C、浓硝酸和浓盐酸的混合物 D、稀硫酸2. 下列四种金属中,能与稀H2SO4反应放出H2的是()A、Cu B、Ag C、Zn D、Hg3. 下列化学反应属于置换反应的是()A、2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ B、CaCO3+CO2+H2O=Ca(HCO3)2 C、2NaNO3 2NaNO2+O2↑ D、CuO+H2 Cu+H2O4. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系见图,分析图象所得的结论中,错误的是( )
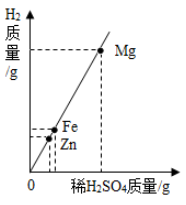 A、三种金属的活动性顺序: B、三种金属的相对原子质量: C、三种金属消耗稀 的质量: D、三种金属与稀 反应后溶液的质量:5. 某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为( )A、70% B、40% C、30% D、60%6. 向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,充分反应后过滤,所得滤液质量仍为m克。下列说法正确的是()A、滤渣中一定有Ag、Cu、Fe B、滤液中一定没有AgNO3 C、滤液中一定含有Zn(NO3)2、Fe(NO3)2 D、该过程至少发生了三个化学反应7. 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是()A、滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2 B、滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2 C、滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3 D、滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO38. 现有 三种金属,若将 分别放入稀硫酸中,只有X溶解并产生气泡;若将 分别放入AgNO3溶液中,Y表面析出银白色固体,而 表面无变化,则三种金属活动性由强到弱的顺序是( )A、 B、 C、 D、9. 将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是()A、
A、三种金属的活动性顺序: B、三种金属的相对原子质量: C、三种金属消耗稀 的质量: D、三种金属与稀 反应后溶液的质量:5. 某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为( )A、70% B、40% C、30% D、60%6. 向m克AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入Zn,充分反应后过滤,所得滤液质量仍为m克。下列说法正确的是()A、滤渣中一定有Ag、Cu、Fe B、滤液中一定没有AgNO3 C、滤液中一定含有Zn(NO3)2、Fe(NO3)2 D、该过程至少发生了三个化学反应7. 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是()A、滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2 B、滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2 C、滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3 D、滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO38. 现有 三种金属,若将 分别放入稀硫酸中,只有X溶解并产生气泡;若将 分别放入AgNO3溶液中,Y表面析出银白色固体,而 表面无变化,则三种金属活动性由强到弱的顺序是( )A、 B、 C、 D、9. 将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是()A、 B、
B、 C、
C、 D、
D、 10. 由两种金属组成的混合物共20g,与足量的盐酸充分反应后,共生成1g氢气,则原混合物的组成不可能是()A、Zn和Mg B、Fe和Mg C、Zn和Fe D、Mg和Cu11. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液的质量与加入Zn的质量的关系如图所示,下列说法错误的是()
10. 由两种金属组成的混合物共20g,与足量的盐酸充分反应后,共生成1g氢气,则原混合物的组成不可能是()A、Zn和Mg B、Fe和Mg C、Zn和Fe D、Mg和Cu11. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液的质量与加入Zn的质量的关系如图所示,下列说法错误的是() A、a点溶液中的溶质有3种 B、c点溶液中的溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,不会产生白色沉淀 D、取d点时的固体,加入稀盐酸,无气泡12. 能验证Zn、Cu、Ag三种金属活动性顺序的是()A、Zn、Ag、CuSO4溶液 B、Zn、Cu、Ag、稀盐酸 C、Cu、Ag、ZnSO4溶液 D、Ag、ZnSO4溶液、CuSO4溶液13. 为比较X、Y、Z三种金属活动性大小,进行如图实验。实验结论正确的是()
A、a点溶液中的溶质有3种 B、c点溶液中的溶质为Zn(NO3)2 C、若取b~c段溶液,滴加稀盐酸,不会产生白色沉淀 D、取d点时的固体,加入稀盐酸,无气泡12. 能验证Zn、Cu、Ag三种金属活动性顺序的是()A、Zn、Ag、CuSO4溶液 B、Zn、Cu、Ag、稀盐酸 C、Cu、Ag、ZnSO4溶液 D、Ag、ZnSO4溶液、CuSO4溶液13. 为比较X、Y、Z三种金属活动性大小,进行如图实验。实验结论正确的是() A、X>Y>Z B、Z>Y>X C、Y>X、Y>Z D、X>Y、Z>Y
A、X>Y>Z B、Z>Y>X C、Y>X、Y>Z D、X>Y、Z>Y二、填空题
-
14. 将一定质量的锌粒投入到含有Cu(NO3)2和Fe(NO3)2的混合溶液中,充分反应后过滤,若滤液呈无色,则滤渣中一定含有 , 滤液中一定含有的溶质是 , 请任写出一个反应的化学方程式。15. 在探究金属活动性顺序时,华雪同学把两根绕成螺旋状的洁净铜丝分别浸入硫酸铝溶液、硝酸银溶液中,过一会儿取出:(1)、铜丝浸入硫酸铝溶液中,可观察到的现象是:。(2)、铜丝浸入硝酸银溶液中,可观察到铜丝上有色物质生成,溶液逐渐变成蓝色。(3)、铜丝浸入硝酸银溶液中,离子数目减少的是 , 离子数目增加的是。(4)、根据上述实验所观察到的现象,华雪同学(填“能”或者“不能”)证明铝、铜、银的金属活动性顺序Al>Cu>Ag16. 金属材料包括铁、铝、铜等纯金属和合金。(1)、人体中含量最高的金属元素是。(2)、因性能优良,被认为是21世纪的重要金属材料是。(3)、铝具有较好的抗腐蚀性能,是因为铝与空气中氧气反应,其表面生成一层致密的氧化膜,请写出该氧化膜的化学式。(4)、FeCl2溶液中混有少量杂质CuCl2 , 简要叙述除杂的操作步骤是 , 除杂的化学反应方程式为。
三、实验探究题
-
17. 某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图甲所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
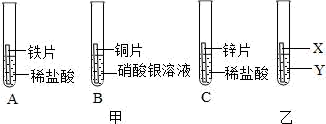 (1)、实验前用砂纸打磨金属的目的是。(2)、一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为色,这说明铜比银的金属活动性(填“强”或“弱”),该反应的化学方程式为。(3)、甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是。(4)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验:X是金属 , Y是溶液。
(1)、实验前用砂纸打磨金属的目的是。(2)、一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为色,这说明铜比银的金属活动性(填“强”或“弱”),该反应的化学方程式为。(3)、甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是。(4)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验:X是金属 , Y是溶液。四、综合题
-
18. 学习金属的化学性质时,小亮同学将一称重后的铜片伸入盛有硝酸银溶液的烧杯中,待溶液颜色变蓝后,取出铜片直接称量,发现其质量增加了ag。请回答:(1)、写出上述反应的化学方程式。(2)、取出铜片后,烧杯内溶液质量减少了克。(3)、小建同学将一定量的铁粉加入取出铜片后的溶液中,充分振荡后过滤,向滤渣中加入稀硫酸,有气泡生成,则可推断滤液中的溶质是。19. 已知置换反应A+B→C+D能够发生.(1)、若D为H 2 ,B为稀硫酸,则A可能为、、、等活泼金属,写出一个符合条件的反应的化学方程式: .(2)、若D为Cu,化合物B可能为(填化学式),写出符合条件的化学方程式: .(3)、某些非金属也有活动性顺序,已知在溶液中可发生如下反应:Cl2+2NaBr=2NaCl+Br2 , Br2+2NaI=2NaBr+I2 . 上述反应属于反应.在I2 、Cl2、Br2三种非金属中,活动性最强的是 , 活动性最弱的是 .
-