浙江省Q21联盟2019-2020学年九年级上学期科学期中质量检测试卷
试卷更新日期:2019-11-25 类型:期中考试
一、选择题(本大题共15小题,1-10小题每题3分,11-15小题每题2分,共40分,每小题只有一个选项是正确的,不选、多选、错选均不得分)
-
1. 衢州是浙江命名的首个“光伏产业基地”。下列过程都与光伏产业有关,其中属于物理变化的是( )A、二氧化硅(SiO2)与焦炭制粗硅(Si) B、氢气与四氯化硅(SiCl4)制纯硅(Si) C、太阳能热水器中冷水变热水 D、在催化剂作用下太阳能光解水制氢气2. 盐酸是初中阶段的三大强酸之一,是较为常见的酸溶液,下列关于盐酸的叙述中,正确的是( )A、纯净的盐酸是纯净物 B、常用的37%的盐酸可以通过加热浓缩使其浓度增大 C、人的胃液里含有盐酸,说明盐酸无腐蚀性 D、浓盐酸在空气中形成白雾,该白雾是盐酸的小液滴3. 2019年以来,猪肉价格飙升,一些不法商贩妄图以变质肉代替新鲜肉,从科学角度上来说,肉类的鲜度可以通过测试pH来判断。有资料显示,pH与肉类新鲜度的关系如下表,则新鲜肉在变质过程中酸性如何变化( )
名称
新鲜肉
次鲜肉
变质肉
pH
5.8﹣6.2
6.3~6.6
>6.6
A、 不变 B、变强 C、变弱 D、无法确定4. 下列各种物质的名称、俗称和化学式表示的是同一种物质的是( )A、氧化钙 熟石灰 CaO B、氢氧化钠 纯碱 NaOH C、氢氧化钠 烧碱 NaOH D、氢氧化钙 石灰石 Ca(OH)25. 如图所示的实验操作或装置正确的是( )A、稀释浓硫酸 B、测溶液的pH
B、测溶液的pH  C、H2还原氧化铜
C、H2还原氧化铜  D、除去CO2中少量HCl气体
D、除去CO2中少量HCl气体  6. 固体酒精也被称为“固体燃料块”,因使用、运输和携带方便而广泛应用于餐饮业和旅游业。其主要成分是乙醇,化学式为CH3CH2OH。关于乙醇,下列说法错误的是( )A、乙醇中碳元素的质量分数为52.2% B、一个乙醇分子中有9个原子 C、乙醇中各元素的质量比C:H:O =2:6:1 D、乙醇是化合物7. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲—戊的反应类型不同于其它几个反应;丙—戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
6. 固体酒精也被称为“固体燃料块”,因使用、运输和携带方便而广泛应用于餐饮业和旅游业。其主要成分是乙醇,化学式为CH3CH2OH。关于乙醇,下列说法错误的是( )A、乙醇中碳元素的质量分数为52.2% B、一个乙醇分子中有9个原子 C、乙醇中各元素的质量比C:H:O =2:6:1 D、乙醇是化合物7. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲—戊的反应类型不同于其它几个反应;丙—戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
A、A B、B C、C D、D8. 中国最新战机使用了高强度、耐高温的钛合金材料.工业上可用如下反应制得:TiCL4+2Mg Ti+2MgCL2下列有关该反应的说法正确的是( ) A、Mg比Ti活泼 B、Mg的化合价降低 C、该反应可以在空气中进行 D、该反应是复分解反应9. 将A克的烧碱溶液与B克的硫酸铜溶液充分混合,将反应所得的混合物过滤,得蓝色沉淀物和无色滤液。下列有关说法中正确的是( )A、滤液中可能含有硫酸铜 B、滤液的pH一定等于7 C、滤液的质量一定小于(A+B)克 D、滤液中含有的溶质只可能为一种10. 已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑。下表为常温下相同浓度溶液的pH;数据揭示出复分解反应的一条规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,下列反应不能进行的是( )
A、Mg比Ti活泼 B、Mg的化合价降低 C、该反应可以在空气中进行 D、该反应是复分解反应9. 将A克的烧碱溶液与B克的硫酸铜溶液充分混合,将反应所得的混合物过滤,得蓝色沉淀物和无色滤液。下列有关说法中正确的是( )A、滤液中可能含有硫酸铜 B、滤液的pH一定等于7 C、滤液的质量一定小于(A+B)克 D、滤液中含有的溶质只可能为一种10. 已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑。下表为常温下相同浓度溶液的pH;数据揭示出复分解反应的一条规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,下列反应不能进行的是( ) A、CH3COOH+NaCN=CH3COONa+HCN B、CO2+H2O+NaClO=NaHCO3+HClO C、NaClO+CH3COOH=HClO+CH3COONa D、CO2+H2O+2NaClO=Na2CO3+2HClO11. 如图所示,小球从高处下落到竖直放置的轻弹簧上,在小球接触弹簧到将弹簧压缩到最短的整个过程中,下列叙述中正确的是( )
A、CH3COOH+NaCN=CH3COONa+HCN B、CO2+H2O+NaClO=NaHCO3+HClO C、NaClO+CH3COOH=HClO+CH3COONa D、CO2+H2O+2NaClO=Na2CO3+2HClO11. 如图所示,小球从高处下落到竖直放置的轻弹簧上,在小球接触弹簧到将弹簧压缩到最短的整个过程中,下列叙述中正确的是( )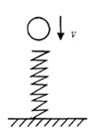 A、小球所受弹簧的弹力始终比重力大 B、小球的速度一直在减小 C、小球到达最低点时所受弹簧的弹力等于重力 D、小球的机械能在不断减少12. 某粗盐固体样品中含有少量CaCl2、MgCl2、Na2SO4、MgSO4和泥沙,进行以下操作可得到纯净的NaCl晶体:①加过量的NaOH溶液;②加H2O;③加过量的BaCl2溶液;④过滤;⑤蒸发;⑥加过量的Na2CO3溶液;⑦加适量的稀盐酸,则正确的操作顺序是( )A、②①③⑥④⑦⑤ B、②①⑥③④⑦⑤ C、①⑥⑦②③④⑤ D、⑥②①③④⑤⑦13. 下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的( )
A、小球所受弹簧的弹力始终比重力大 B、小球的速度一直在减小 C、小球到达最低点时所受弹簧的弹力等于重力 D、小球的机械能在不断减少12. 某粗盐固体样品中含有少量CaCl2、MgCl2、Na2SO4、MgSO4和泥沙,进行以下操作可得到纯净的NaCl晶体:①加过量的NaOH溶液;②加H2O;③加过量的BaCl2溶液;④过滤;⑤蒸发;⑥加过量的Na2CO3溶液;⑦加适量的稀盐酸,则正确的操作顺序是( )A、②①③⑥④⑦⑤ B、②①⑥③④⑦⑤ C、①⑥⑦②③④⑤ D、⑥②①③④⑤⑦13. 下列各组物质的溶液,不用其他试剂,只用观察和组内物质的溶液相互混合的方法,就能将它们一一鉴别出来的( )①NaCl、BaCl2、CuSO4、NaOH、NH4NO3②Ba(NO3)2、NaCl、Na2SO4、H2SO4、HCl
③NaOH、FeCl3、MgSO4、BaCl2、KCl ④AgNO3、HCl、K2CO3、NaCl、BaCl2
A、①③④ B、①②③ C、①②④ D、②④14. 逻辑推理是一种重要的化学思维方法。以下推理正确的是( )A、氧化物中含有氧元素,含氧元素的化合物一定是氧化物 B、单质中只含有一种元素,只含有一种元素的物质一定是单质 C、碱性溶液能使无色酚酞溶液变红,能使无色酚酞溶液变红的溶液一定是碱性溶液 D、可燃物燃烧时温度需要达到着火点,温度达到着火点时可燃物一定能燃烧15. 下列四个图像中不能正确反应其对应实验操作的是( ) A、向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸 B、向一定量的氢氧化钡溶液中不断加入稀硫酸 C、等质量的块状石灰石和粉末状石灰石分别与质量分数相同的足量的稀盐酸反应 D、一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应
A、向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸 B、向一定量的氢氧化钡溶液中不断加入稀硫酸 C、等质量的块状石灰石和粉末状石灰石分别与质量分数相同的足量的稀盐酸反应 D、一定量的氢氧化钠溶液中,通入二氧化碳,至恰好完全反应二、填空题(本题有8小题,16-17每空3分,18-23每空2分,共40分)
-
16. 科学来源于生活,生活中处处都有科学知识。(1)、下列哪些物质的主要成分是有机物。(填序号)
①木炭 ②白酒 ③头发 ④醋酸 ⑤小苏打 ⑥蛋清 ⑦生石灰
(2)、胃液中含有适量的盐酸。由于胃酸过多而引起的胃痛,可服用含有 Mg(OH)2 的药物来中和过多的胃酸,发生反应的化学方程式为。17. 美国飞行器制造商特拉弗吉亚公司近日宣布了其研发的世界首款飞行汽车,它拥有两个座位、四个轮子和能够折叠的翅膀,使用汽油为燃料,既能像轿车一样在公路上行驶,又能像直升飞机一样实现起降、悬停、飞行. (1)、当飞行汽车悬停在空中时(如图所示),其螺旋桨产生的升力(选填“大于”、“小于”或“等于”)汽车和乘员的总重力.(2)、这种飞行汽车行驶、飞行所需的能量来自汽油,这种储存在汽油里的能是。18. 我国自行研发的大型客机C919于今年5月成功试飞,请根据所学知识回答问题。(1)、选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度(填“大于”或“小于”)纯铝。(2)、飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与接触。19. 根据酸的化学性质回答下列问题。
(1)、当飞行汽车悬停在空中时(如图所示),其螺旋桨产生的升力(选填“大于”、“小于”或“等于”)汽车和乘员的总重力.(2)、这种飞行汽车行驶、飞行所需的能量来自汽油,这种储存在汽油里的能是。18. 我国自行研发的大型客机C919于今年5月成功试飞,请根据所学知识回答问题。(1)、选用铝合金做飞机机身而不选用纯铝,主要原因是铝合金硬度和强度(填“大于”或“小于”)纯铝。(2)、飞机上的镀铬铁制品能防锈蚀,其防锈原理是阻止了铁与接触。19. 根据酸的化学性质回答下列问题。 (1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质②,反应前后溶液颜色发生改变的一个反应的化学方程式。20. 无土栽培是利用营养液栽培作物的一种方法.现有一种无色营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,阳阳同学设计并完成了如下图所示的实验.根据以上实验,请你进行有关推断,完成问题.
(1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质②,反应前后溶液颜色发生改变的一个反应的化学方程式。20. 无土栽培是利用营养液栽培作物的一种方法.现有一种无色营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,阳阳同学设计并完成了如下图所示的实验.根据以上实验,请你进行有关推断,完成问题. (1)、由实验1、实验2推测原营养液的组成可能有种情况。(2)、若测得原营养液中K+和Cl−的数目之比为1:1,则原营养液的组成中的溶质是。
(1)、由实验1、实验2推测原营养液的组成可能有种情况。(2)、若测得原营养液中K+和Cl−的数目之比为1:1,则原营养液的组成中的溶质是。
21. 二氧化硫是大气的主要污染物,严禁直接排放,工业上常用NaOH溶液来吸收。 (1)、写出NaOH溶液吸收SO2的化学方程式。(2)、图中小球分别表示NaOH溶液及吸收SO2后所得溶液中溶质的微粒,其中“●”表示的微粒是。22. 有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验.
(1)、写出NaOH溶液吸收SO2的化学方程式。(2)、图中小球分别表示NaOH溶液及吸收SO2后所得溶液中溶质的微粒,其中“●”表示的微粒是。22. 有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验.
请回答下列问题:
(1)、过滤操作中用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是。(2)、滤渣a的成分是 , 滤液中溶质的成分除氯化钠还有。23. 如图是我市一些街道边新安装的“太阳能垃圾箱”。该垃圾箱“头顶”光电池板,“腰挎”广告灯箱,“脚踩”垃圾桶。 (1)、太阳能电池板的主要材料为硅,硅属于(选填“金属”或“非金属”)(2)、废电池应该投入到其中的垃圾桶(选填“可回收”或“不可回收”),以防渗漏出的汞、镉、铅等重金属离子对土壤和水源造成污染。
(1)、太阳能电池板的主要材料为硅,硅属于(选填“金属”或“非金属”)(2)、废电池应该投入到其中的垃圾桶(选填“可回收”或“不可回收”),以防渗漏出的汞、镉、铅等重金属离子对土壤和水源造成污染。三、实验探究题(本题有5小题,每空2分,共36分)
-
24. 化学小组为探究铁、铜、锌、银的金属活动性顺序,设计如图甲的三个实验(其中金属均已打磨,其形状、大小及同种稀盐酸的用量均相同):
 (1)、实验一段时间后,观察到实验②的铜片表面有银白色固体附着,这说明铜比银的活泼性(选填“强”或“弱”)。(2)、甲同学认为通过实验①和③可比较锌和铁的金属活动性,他依据的实验现象是。(3)、乙同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质分别补充了一个实验(如图乙所示),都实现了探究目的,则:乙同学的实验:X是金属 , Y是。25. 目前在我国,交通事故已经成为危及人民群众生命财产安全的“第一杀手”,为了研究汽车超载和超速带来的安全隐患,小龙同学设计了如图甲、乙、丙所示的实验。将A、B、C三个小球(mA=mB<mC)先后从同一装置、高度分别为hA、hB、hC的三个位置滚下(hA=hC>hB),推动小木块运动一段距离后静止,实验结果如图所示。则:
(1)、实验一段时间后,观察到实验②的铜片表面有银白色固体附着,这说明铜比银的活泼性(选填“强”或“弱”)。(2)、甲同学认为通过实验①和③可比较锌和铁的金属活动性,他依据的实验现象是。(3)、乙同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质分别补充了一个实验(如图乙所示),都实现了探究目的,则:乙同学的实验:X是金属 , Y是。25. 目前在我国,交通事故已经成为危及人民群众生命财产安全的“第一杀手”,为了研究汽车超载和超速带来的安全隐患,小龙同学设计了如图甲、乙、丙所示的实验。将A、B、C三个小球(mA=mB<mC)先后从同一装置、高度分别为hA、hB、hC的三个位置滚下(hA=hC>hB),推动小木块运动一段距离后静止,实验结果如图所示。则: (1)、若水平面绝对光滑,本实验还能达到探究目的吗?并说明理由:。(2)、本实验中通过观察来比较小球到达水平面时的动能大小。(3)、选择两图所示实验进行比较,是用来研究汽车超速带来的安全隐患;(4)、甲、丙两图所示实验中hA=hC是为了控制相同;26. 天然气作为燃料已进入千家万户,小聪在帮助父母烧菜时想到,天然气燃烧的产物是什么呢?带着这一问题,小聪和同学们一起进行了如下的探究。
(1)、若水平面绝对光滑,本实验还能达到探究目的吗?并说明理由:。(2)、本实验中通过观察来比较小球到达水平面时的动能大小。(3)、选择两图所示实验进行比较,是用来研究汽车超速带来的安全隐患;(4)、甲、丙两图所示实验中hA=hC是为了控制相同;26. 天然气作为燃料已进入千家万户,小聪在帮助父母烧菜时想到,天然气燃烧的产物是什么呢?带着这一问题,小聪和同学们一起进行了如下的探究。 (1)、设计与实验,同学们设计了甲图装置(固定装置未画出),将天然气在氧气中点燃后得到的混合气体通过该装置进行实验,开始时应(填“先通气体”、“先加热”),加热过程中发现黑色CuO固体变红,澄清石灰水变浑浊。写出CuO固体变红的化学方程式。仅根据甲图装置出现的现象,写出混合气体所有的可能组成。(2)、评价与改进:小聪认为上述实验方案有缺陷,通过讨论,增加了乙图中的3个装置(固定装置未画出),对方案作了改进并进行实验,将混合气体先通过乙图中连接的装置后,再通入甲图装置,实验中部分现象如下:A装置质量增加,B装置中溶液不变浑浊,甲图装置中实验现象与(1)相同。
(1)、设计与实验,同学们设计了甲图装置(固定装置未画出),将天然气在氧气中点燃后得到的混合气体通过该装置进行实验,开始时应(填“先通气体”、“先加热”),加热过程中发现黑色CuO固体变红,澄清石灰水变浑浊。写出CuO固体变红的化学方程式。仅根据甲图装置出现的现象,写出混合气体所有的可能组成。(2)、评价与改进:小聪认为上述实验方案有缺陷,通过讨论,增加了乙图中的3个装置(固定装置未画出),对方案作了改进并进行实验,将混合气体先通过乙图中连接的装置后,再通入甲图装置,实验中部分现象如下:A装置质量增加,B装置中溶液不变浑浊,甲图装置中实验现象与(1)相同。请你写出改进方案的装置连接顺序(装置不重复使用),混合气体→→甲图装置(填装置编号)。
交流与讨论:通过对改进实验的现象分析,同学们得出了正确的结论。
27. 小红、小军、小明三人化学学习小组在实验中,用到了三个分别盛有KCl溶液、KOH溶液、K2SO4溶液的滴瓶.小军发现小红将三个滴瓶中的三只滴管混用,认为小红实验操作不规范,滴瓶中的试剂会因此受污染而无法再次使用,学习小组就盛有KCl溶液的滴瓶是否被另外两种试剂污染进行了如下探究.【提出问题】该滴瓶中溶质的成分是什么?
(1)、【提出猜想】通过分析,提出如下猜想:猜想Ⅰ溶质成分只有:KCl; 猜想Ⅱ溶质成分为:KCl和KOH;
猜想Ⅲ溶质成分为:KCl、K2SO4; 猜想Ⅳ溶质成分为:KCl、KOH和K2SO4 .
【实验探究】为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告;
实验操作
实验现象
结论或解释
(1)取该滴瓶内溶液于试管中,向试管中加入适量BaCl2溶液
溶质中有K2SO4
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入酚酞试液
证明猜想Ⅳ成立
(2)、【实验反思】小明认为该实验方案并未证明猜想Ⅱ、Ⅲ是否成立,应补充相应实验予以证明,你是否赞同?(选填“是”或“否”).28. 足球比赛中让意外昏迷的球员快速恢复意识会用到“嗅盐”。同学们对“嗅盐”产生了好奇,并对其成分进行了如下探究。(查阅资料)①嗅盐是一种盐类物质和香料(不参与下列探究中的任何反应)组成,能释放出氨味气体,对人体神经会产生强烈的刺激作用,但过量吸入会危害健康。②氯化钙稀溶液与碳酸氢铵溶液不发生反应。③氨气能与硫酸化合生成硫酸铵。
(提出问题)嗅盐中盐类物质是什么?
(实验探究)填写表中空格。
实验
小军的实验
小英的实验
方案

嗅盐与(填一种物质名称)混合研磨


现象
闻到较浓烈刺激性气味且试纸变蓝
结论
嗅盐中含有NH4+
嗅盐中含有CO32-
确认了小军的实验结论
证明嗅盐中盐类物质是碳酸铵
(质疑)小英认为小军的实验不严谨,小英通过补做一个实验(方案见上表),进而确认了小军的结论。
四、解答题(本题有6小题,29题4分,30题7分,31题9分,32题7分,33题8分,34题9分,共44分
-
29. 已知金属和酸反应受温度和溶液的溶质质量分数影响。现将未经砂纸打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强随反应时间的变化曲线如图所示,试分析曲线AB、BC和CD变化的原因。
 30. 在用稀盐酸和氢氧化钡溶液进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。
30. 在用稀盐酸和氢氧化钡溶液进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。 (1)、根据此变化曲线,你认为实验操作是将滴加到另一种溶液中。(写化学式)(2)、当加入溶液的质量是a克时,溶液中溶质是(写化学式)。(3)、求恰好完全反应时溶液中溶质的质量分数。31. 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:
(1)、根据此变化曲线,你认为实验操作是将滴加到另一种溶液中。(写化学式)(2)、当加入溶液的质量是a克时,溶液中溶质是(写化学式)。(3)、求恰好完全反应时溶液中溶质的质量分数。31. 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:猜想一:可能部分变质,固体是NaOH和Na2CO3的混合物;
猜想二:可能全部变质,固体是Na2CO3.
(1)、首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是。(填写化学式)(2)、称取5.3g该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:计算该样品中Na2CO3的质量分数.
样品质量
反应前总质量
反应后总质量
5.3g
74.25g
73.15g
(3)、再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如右图所示.从图中可以判断:在该样品溶液中加入稀盐酸,首先与之反应的物质是。 (4)、请你分析,一定质量的NaOH固体,变质前后都与相同质量分数的稀盐酸恰好完全反应,则变质前消耗盐酸的量变质后消耗盐酸的量(填“大于”、“小于”或“等于”)。32. 小菁为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%。
(4)、请你分析,一定质量的NaOH固体,变质前后都与相同质量分数的稀盐酸恰好完全反应,则变质前消耗盐酸的量变质后消耗盐酸的量(填“大于”、“小于”或“等于”)。32. 小菁为了探究某冶炼厂赤铁矿石中氧化铁的质量分数,设计了如图所示的装置进行实验,测得赤铁矿石中氧化铁的质量分数为80%。 (1)、现炼铁厂利用该赤铁矿石5000t,理论上可炼出纯铁多少吨?(2)、在利用如图装置进行实验时,小菁得到如下两组数据(杂质不参加反应)
(1)、现炼铁厂利用该赤铁矿石5000t,理论上可炼出纯铁多少吨?(2)、在利用如图装置进行实验时,小菁得到如下两组数据(杂质不参加反应)你认为他应该选用了(填“A”或“B”)组数据来计算赤铁矿石中氧化铁的质量分数;结合装置图回答他不选用另一组数据计算可能的原因。(写出一点即可)
反应前
反应后
A组
玻璃管和赤铁矿石样品的质量m1g
玻璃管和固体物质的质量m2g
B组
烧杯和澄清石灰水的质量m3g
烧杯和烧杯中物质的质量m4g
33. 生产生活中,有的人利用潲水油、地沟油烹饪食品损害人类健康,有的人则利用它制造生物柴油造福人类。生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇(化学式CH3OH)在催化剂作用下,进行酯交换制成的液体燃料。生物柴油是一种洁净的生物燃料,可代替石化柴油应用于航空、汽车等领域,不但性能优于石化柴油,而且价格更低,是可再生的绿色能源。根据以上信息回答下列问题:(1)、小靖想尝试比较地沟油和花生油的物理性质。她将分别盛有这两种的杯子一起放入冰箱内降温,她发现两杯的温度都降到7℃时,地沟油变为固态而花生油仍为液态,这说明地沟油和花生油具有不同的。(2)、地沟油中含有杂质及有毒物质,小明想对它进行研究,小明找到质量为0.46kg的,测出其体积为0.5L,则该的密度是kg/m3。(3)、潲水油、地沟油、生物柴油属于(选填“纯净物”或“混合物”);(4)、使用生物柴油具有的好处有。(请写出1点)34. 某合金是由铜与镁、锌两种金属中的一种组成的,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四份依次加入该烧杯中,每次均充分反应,实验数据如下:
请计算:
(1)、该合金中铜的质量分数为多少?(2)、通过计算确定:该合金除铜外另一种金属是镁、锌中的哪一种?(3)、第三次加入稀硫酸充分反应后,所得溶液中溶质质量分数为多少?(精确到0.1%)