2016-2017学年江西省赣州市十四县(市)联考高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、选择题
-
1. 在如图所示的微粒中,结合电子能力最强的是( )A、
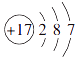 B、
B、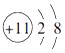 C、
C、 D、
D、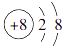 2. 图中没有涉及到的能量转化形式是( )
2. 图中没有涉及到的能量转化形式是( ) A、化学能转化为热能 B、太阳能转化为化学能 C、势能转化为电能 D、化学能转化为势能3. 下列元素属于长周期主族元素的是( )A、Li B、P C、Fe D、Br4. 下列电子式书写错误的是( )A、
A、化学能转化为热能 B、太阳能转化为化学能 C、势能转化为电能 D、化学能转化为势能3. 下列元素属于长周期主族元素的是( )A、Li B、P C、Fe D、Br4. 下列电子式书写错误的是( )A、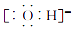 B、
B、 C、
C、 D、
D、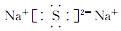 5. 短周期元素的性质递变规律如图所示,下列说法正确的是( )
5. 短周期元素的性质递变规律如图所示,下列说法正确的是( ) A、横坐标为质子数,纵坐标为元素的最高正价 B、横坐标为原子序数,纵坐标为元素原子的最外层电子数 C、横坐标为核电荷数,纵坐标为元素原子的半径 D、横坐标为中子数,纵坐标为元素的非金属性6. 一定条件下,将1mol X气体和1mol Y气体充入一1L的恒容密闭容器中,发生反应:X(g)+2Y(g)⇌3Z(g),1s后测得c(Y)=0.6mol•I﹣1 , 则0~1s内Y的平均反应速率为( )A、0.2 mol•L﹣1•s﹣1 B、0.4 mol•L﹣1•s﹣1 C、0.6 mol•L﹣1•s﹣1 D、0.8 mol•L﹣1•s﹣17. 下列说法正确的是( )A、元素的种类由最外层电子数决定 B、化学键是存在于分子、原子和离子间的作用力 C、原子的种类由原子核内质子数与中子数共同决定 D、化学反应速率可以决定反应的限度8. 设NA为阿伏加德罗常数的数值,下列说法不正确的是( )A、标准状况下,22.4 LH2O中含有极性键的数目为2NA B、78 g Na2O2中含有的阴离子数为NA C、11 g重水(D218O)中含有的电子数力5NA D、常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA9. 下列不能说明硫的非金属性比氯的非金属性弱的是( )A、硫酸比次氯酸稳定 B、硫酸的酸性弱于高氯酸 C、H2S比HCl被氧化 D、气态HCl比气态H2S稳定10. 下列反应的离子方程式书写正确的是( )A、氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣ B、将过量氨水加入AlCl3溶液中:Al3++4OH﹣═AlO2﹣+2H2O C、酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+═3I2+3H2O D、向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+CO32﹣+2H2O11. 下列各组微粒具有相同的质子数和电子数的是( )A、OH﹣、H2O B、NH3、NH4+ C、H3O+、NH2﹣ D、HCl、H2S12. 下列实验操作正确且能达到相应实验目的是( )
A、横坐标为质子数,纵坐标为元素的最高正价 B、横坐标为原子序数,纵坐标为元素原子的最外层电子数 C、横坐标为核电荷数,纵坐标为元素原子的半径 D、横坐标为中子数,纵坐标为元素的非金属性6. 一定条件下,将1mol X气体和1mol Y气体充入一1L的恒容密闭容器中,发生反应:X(g)+2Y(g)⇌3Z(g),1s后测得c(Y)=0.6mol•I﹣1 , 则0~1s内Y的平均反应速率为( )A、0.2 mol•L﹣1•s﹣1 B、0.4 mol•L﹣1•s﹣1 C、0.6 mol•L﹣1•s﹣1 D、0.8 mol•L﹣1•s﹣17. 下列说法正确的是( )A、元素的种类由最外层电子数决定 B、化学键是存在于分子、原子和离子间的作用力 C、原子的种类由原子核内质子数与中子数共同决定 D、化学反应速率可以决定反应的限度8. 设NA为阿伏加德罗常数的数值,下列说法不正确的是( )A、标准状况下,22.4 LH2O中含有极性键的数目为2NA B、78 g Na2O2中含有的阴离子数为NA C、11 g重水(D218O)中含有的电子数力5NA D、常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA9. 下列不能说明硫的非金属性比氯的非金属性弱的是( )A、硫酸比次氯酸稳定 B、硫酸的酸性弱于高氯酸 C、H2S比HCl被氧化 D、气态HCl比气态H2S稳定10. 下列反应的离子方程式书写正确的是( )A、氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣ B、将过量氨水加入AlCl3溶液中:Al3++4OH﹣═AlO2﹣+2H2O C、酸性溶液中KIO3与KI反应生成I2:IO3﹣+5I﹣+6H+═3I2+3H2O D、向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+CO32﹣+2H2O11. 下列各组微粒具有相同的质子数和电子数的是( )A、OH﹣、H2O B、NH3、NH4+ C、H3O+、NH2﹣ D、HCl、H2S12. 下列实验操作正确且能达到相应实验目的是( )选项
实验目的
实验操作
A
称取2.0g NaOH固体
先在左、右两托盘上各放一张滤纸,然后在有盘上添加2g砝码,左盘上添加NaOH固体
B
检验试液巾是否含有NH4+
取少量试液于试管巾,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
C
除去CO2中混有的杂质SO2
将混合气体通入盛有澄清石灰水的洗气瓶中
D
验证金属钠比铜活泼
将钠加入1.0mol•L﹣1的CuSO4溶液中
A、A B、B C、C D、D13. 汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( ) A、该反应是放热反应 B、该反应是氧化还原反应 C、该反应过程中有共价键的断裂和形成 D、使用催化剂可以改变反应速率14. 一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,说明反应达到平衡状态的是 ( )
A、该反应是放热反应 B、该反应是氧化还原反应 C、该反应过程中有共价键的断裂和形成 D、使用催化剂可以改变反应速率14. 一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,说明反应达到平衡状态的是 ( )①恒容时发生反应:A(g)+B(g)⇌3C(g)
②恒压时发生反应:A(g)+B(g)⇌2C(g)
③恒容时发生反应:A(g)+2B(g)⇌2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)⇌3C(g)J﹣D(s)
A、②③ B、①④ C、①③ D、②④15. 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )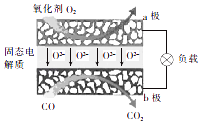 A、电子从b极经导线流向a极 B、正极的电极反应式为O2+4e﹣+2H2O═4OH﹣ C、还可以选用NaOH固体作固态电解质 D、若反应中转移1 mol电子,则生成22.4L(标准状况)CO216. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2 , Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述不正确的是( )A、W、X、Y、Z最外层电子数之和为20 B、WX2、YX2和ZX2均只含共价键 C、原子半径的大小顺序为X<W<Y<Z D、Z的气态氢化物比Y的稳定
A、电子从b极经导线流向a极 B、正极的电极反应式为O2+4e﹣+2H2O═4OH﹣ C、还可以选用NaOH固体作固态电解质 D、若反应中转移1 mol电子,则生成22.4L(标准状况)CO216. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2 , Y原子的内层电子总数是其最外层电子数的2.5倍.下列叙述不正确的是( )A、W、X、Y、Z最外层电子数之和为20 B、WX2、YX2和ZX2均只含共价键 C、原子半径的大小顺序为X<W<Y<Z D、Z的气态氢化物比Y的稳定二、非选择题
-
17. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为
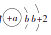 .请回答下列问题:
.请回答下列问题: W
X
Y
Z
(1)、Z元素位于元素周期表中第周期族.(2)、X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于 (填“离子化合物”或“共价化合物”).(3)、X、Y、Z三种元素的原子半径由大到小的顺序为(用元素符号表示).(4)、写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式: .18. 以石英、焦炭为原料的部分化工流程如图所示.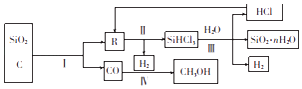
回答下列问题:
(1)、反应I在工业上的作用是生产粗硅,为鉴定产品R中是否含有微量的铁单质,取少量R,用稀盐酸溶解,取上层清液后需再加入的试剂是(填字母).a.碘水 b.氯水 c.KSCN溶液 d.NaCl溶液
(2)、反应Ⅱ要在干燥环境下迸行,其原因是;经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量SiCl4沸点为57.6℃)和HCl(沸点为﹣84.7℃),则提纯SiHCl3的方法为 .(3)、将水蒸气通过灼热的煤粉可产生水煤气,其主要成分是CO、H2 . 工业上将水煤气液化后制得的CH3OH中含有的化学键类型为(填“离子键”或“共价键”);流程图中的反应Ⅲ为氧化还原反应,其化学方程式为 .19. 氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.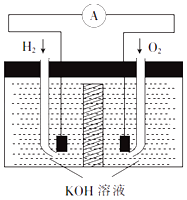 (1)、氢氧燃料电池能量转化的主要形式是(填“电能转化为化学能”或“化学能转化为电能”).(2)、通入H2的电极为(填“正极”或“负极”),该电极的电极反应式为 .(3)、电极表面镀铂粉的原因是 .(4)、随着电池不断放电,电解质溶液的碱性(填“增强”“减弱”或“不变”).20. 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)⇌N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.
(1)、氢氧燃料电池能量转化的主要形式是(填“电能转化为化学能”或“化学能转化为电能”).(2)、通入H2的电极为(填“正极”或“负极”),该电极的电极反应式为 .(3)、电极表面镀铂粉的原因是 .(4)、随着电池不断放电,电解质溶液的碱性(填“增强”“减弱”或“不变”).20. 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)⇌N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.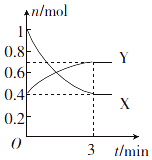 (1)、曲线(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线.(2)、在0~3min内,用NO2表示的反应速率为 .(3)、下列叙述能说明该反应已达到化学平衡状态的是(填字母).
(1)、曲线(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线.(2)、在0~3min内,用NO2表示的反应速率为 .(3)、下列叙述能说明该反应已达到化学平衡状态的是(填字母).a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)、反应达到平衡后,若降低温度,则v(正) , v(逆) . (填“增大”“减小”或“不变”).21. 已知五种短周期元素在周期表中的相对位置如表所示.a
b
c
d
e
(1)、表中五种元素金属性最强的元素为(填元素符号),c、e两元素形成的离子化合物c2e的电子式为 .(2)、c、d、e三种元素的简单离子中,半径最小的是(用元素符号表示).(3)、b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为(用化学式表示).(4)、已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.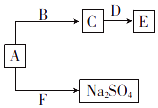
①写出物质E的化学式: .
②写出A与F反应的化学方程式: .
22.草酸与高锰酸钾在酸性条件下能够发生反应:MnO4+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.

实验编号
A溶液
B溶液
①
2mL 0.1mol/LH2C2O4溶液
4mL0.0l1mol/L酸性KMnO4溶液
②
2mL 0.2mol/LH2C2O4溶液
4mL0.01 mol/L酸性KMnO4溶液
(1)、该反应中氧化剂和还原剂的物质的量之比为 .(2)、该实验探究的是对反应速率的影响.实现该实验目的还欠缺的仪器: . 比较①、②两组化学反应速率大小的方法是 .乙组方案:用4mL0.0l1mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
实验编号
10%硫酸的体积/mL
温度/℃
其他物质
Ⅰ
2
20
﹣
Ⅱ
2
20
少量MnSO4粉末
Ⅲ
2
30
﹣
Ⅳ
1
20
1mL蒸馏水
(3)、若要研究催化剂对化学反应速率的影响,则应对比实验(填序号,下同);若要研究温度对化学反应速率的影响,则应对比实验 .(4)、对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 .