2016-2017学年江苏省宿迁市沭阳县高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、选择题单项选择题:
-
1. “低碳经济,节能减排”是当今世界经济发展的新思路.”下列与之相悖的是( )A、着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 B、为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 C、大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 D、大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间2. 下列化学用语表述正确的是( )A、氯气的电子式:
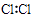 B、氮气的结构式:
B、氮气的结构式: 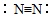 C、F一的结构示意图:
C、F一的结构示意图:  D、H2O2的电子式:
D、H2O2的电子式: 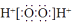 3. 同分异构体具有相同的:①最简式 ②分子式 ③相对分子质量 ④化学性质 ⑤物理性质( )A、①②③ B、②⑤ C、②④⑤ D、②③④4. 澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的关系是( )A、同一种物质 B、同分异构体 C、同位素 D、同素异形体5. 以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是( )A、
3. 同分异构体具有相同的:①最简式 ②分子式 ③相对分子质量 ④化学性质 ⑤物理性质( )A、①②③ B、②⑤ C、②④⑤ D、②③④4. 澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与金刚石的关系是( )A、同一种物质 B、同分异构体 C、同位素 D、同素异形体5. 以下是一些分子的比例模型,其中空间结构和原子大小比例错误的是( )A、 NH3
B、
NH3
B、 H2O
C、
H2O
C、 HCl
D、
HCl
D、 CCl4
6. 下列变化中,需要吸收热量用于克服分子间作用力的是( )A、干冰置于空气中升华 B、加热使石英熔化 C、将食盐溶解于水 D、加热使硫化氢分解7. 下列关于元素周期表的叙述中正确的是( )A、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B、元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 C、主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→→ⅦB) D、除零族外,由长、短周期元素共同组成的元素族称为主族8. 含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )A、金属性比钾强 B、最高价氧化物的化学式是SeO3 C、高价含氧酸的酸性:H2SeO4>H2SO4 D、氢化物稳定性:H2Se>H2O9. 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )
CCl4
6. 下列变化中,需要吸收热量用于克服分子间作用力的是( )A、干冰置于空气中升华 B、加热使石英熔化 C、将食盐溶解于水 D、加热使硫化氢分解7. 下列关于元素周期表的叙述中正确的是( )A、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B、元素周期表共七个横行代表七个周期,18 个纵横代表18 个族 C、主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→→ⅦB) D、除零族外,由长、短周期元素共同组成的元素族称为主族8. 含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )A、金属性比钾强 B、最高价氧化物的化学式是SeO3 C、高价含氧酸的酸性:H2SeO4>H2SO4 D、氢化物稳定性:H2Se>H2O9. 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸.则下列判断错误的是( )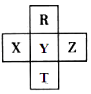 A、原子半径 Z>Y>R B、R与Y的电子数相差8 C、非金属性:Z>Y>X D、HZO4是目前无机酸中最强的含氧酸10. 运用元素周期律分析下面的推断,其中不正确的是( )A、钾与水反应,比钠与水反应更剧烈 B、砹(At)为深色固体,AgAt也难溶于水也不溶于稀硝酸 C、在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂 D、HClO的酸性比H2CO3的酸性强11. 相同材质的铁在图中的四种情况下最不易被腐蚀的是( )A、
A、原子半径 Z>Y>R B、R与Y的电子数相差8 C、非金属性:Z>Y>X D、HZO4是目前无机酸中最强的含氧酸10. 运用元素周期律分析下面的推断,其中不正确的是( )A、钾与水反应,比钠与水反应更剧烈 B、砹(At)为深色固体,AgAt也难溶于水也不溶于稀硝酸 C、在空气中加热,铷(Rb)的氧化产物比钠的氧化产物更复杂 D、HClO的酸性比H2CO3的酸性强11. 相同材质的铁在图中的四种情况下最不易被腐蚀的是( )A、 B、
B、 C、
C、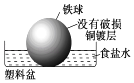 D、
D、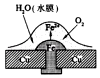 12. 下列反应既属于非氧化还原反应,又属于吸热反应的是( )A、高温下炭与CO2的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、生石灰溶于水的反应 D、盐酸与烧碱溶液的中和反应13. 下列装置工作时,将化学能转化为电能的是( )A、
12. 下列反应既属于非氧化还原反应,又属于吸热反应的是( )A、高温下炭与CO2的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、生石灰溶于水的反应 D、盐酸与烧碱溶液的中和反应13. 下列装置工作时,将化学能转化为电能的是( )A、 煤气灶
B、
煤气灶
B、 铅蓄电池
C、
铅蓄电池
C、 风力发电
D、
风力发电
D、 光伏发电
14. 根据热化学方程式:S(g)+O2(g)═SO2(g)△H=﹣Q KJ•mol﹣1 , 下列分析正确的是( )A、该反应的反应物总能量比产物总能量低QkJ B、1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 C、在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ D、1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量15. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是
光伏发电
14. 根据热化学方程式:S(g)+O2(g)═SO2(g)△H=﹣Q KJ•mol﹣1 , 下列分析正确的是( )A、该反应的反应物总能量比产物总能量低QkJ B、1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 C、在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ D、1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量15. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是( )
 A、直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 B、2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 C、断裂1 mol NO分子中的化学键,需要吸收632KJ能量 D、该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.16. 一个化学电池的总反应方程式为:Zn+2H+═Zn2++H2↑,该化学电池的组成可能为( )
A、直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量 B、2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量 C、断裂1 mol NO分子中的化学键,需要吸收632KJ能量 D、该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.16. 一个化学电池的总反应方程式为:Zn+2H+═Zn2++H2↑,该化学电池的组成可能为( )A
B
C
D
正极
碳棒
Cu
Zn
Mg
负极
Zn
Zn
Cu
Zn
电解质溶液
H2SO4
CuSO4
NaCl
HCl
A、A B、B C、C D、D17. 如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )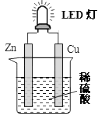 A、铜是负极,电子从铜片经导线流向锌片 B、大多数氢离子在锌片上获得电子被还原 C、装置中存在“化学能→电能→光能”的转换 D、如果将硫酸换成西红柿汁,导线中不会有电子流动18. 常温下,用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )A、水浴加热 B、将稀硫酸改为98%的浓硫酸 C、滴加少许CuSO4溶液 D、改用铁粉并振荡19. 下列说法中正确的是( )A、在多电子的原子里,能量高的电子通常在离核较近的区域内运动 B、凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 C、Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O﹣O共价键 D、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献20. 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
A、铜是负极,电子从铜片经导线流向锌片 B、大多数氢离子在锌片上获得电子被还原 C、装置中存在“化学能→电能→光能”的转换 D、如果将硫酸换成西红柿汁,导线中不会有电子流动18. 常温下,用铁片和稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )A、水浴加热 B、将稀硫酸改为98%的浓硫酸 C、滴加少许CuSO4溶液 D、改用铁粉并振荡19. 下列说法中正确的是( )A、在多电子的原子里,能量高的电子通常在离核较近的区域内运动 B、凡单原子形成的稳定离子,一定具有稀有气体元素原子的8电子稳定结构 C、Na2O2属于离子化合物,熔化时只破坏离子键,不破坏O﹣O共价键 D、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献20. 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )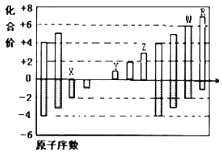 A、原子半径:W>Z>Y B、气态氢化物的稳定性:H2X<H2W C、Y2X和水反应能生成离子化合物 D、Y和Z两者氧化物对应的水化物不能相互反应21. 反应A(g)+3B(g)═2C(g)+2D(g),在四种不同的情况下的反应速率v,其中反应进行最快的是( )A、v(A)=0.2mol•(L•s)﹣1 B、v(C)=0.5 mol•(L•s)﹣1 C、v(B)=0.6 mol•(L•s)﹣1 D、v(D)=0.3 mol•(L•s)﹣122. 在一定条件下的定容密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g),下列哪种情况,能表明反应达到平衡状态( )A、SO3的体积百分含量保持不变 B、SO2速率是O2速率的2倍 C、SO3的浓度是O2浓度的2倍 D、单位时间内SO2消耗的浓度等于SO3生成的浓度23. 据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中正确的是( )
A、原子半径:W>Z>Y B、气态氢化物的稳定性:H2X<H2W C、Y2X和水反应能生成离子化合物 D、Y和Z两者氧化物对应的水化物不能相互反应21. 反应A(g)+3B(g)═2C(g)+2D(g),在四种不同的情况下的反应速率v,其中反应进行最快的是( )A、v(A)=0.2mol•(L•s)﹣1 B、v(C)=0.5 mol•(L•s)﹣1 C、v(B)=0.6 mol•(L•s)﹣1 D、v(D)=0.3 mol•(L•s)﹣122. 在一定条件下的定容密闭容器中,发生反应2SO2(g)+O2(g)⇌2SO3(g),下列哪种情况,能表明反应达到平衡状态( )A、SO3的体积百分含量保持不变 B、SO2速率是O2速率的2倍 C、SO3的浓度是O2浓度的2倍 D、单位时间内SO2消耗的浓度等于SO3生成的浓度23. 据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中正确的是( )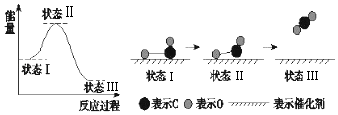 A、状态Ⅰ→状态Ⅲ是放热过程 B、该过程中,CO先断键形成C和O,再生成CO2 C、状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2 D、状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用
A、状态Ⅰ→状态Ⅲ是放热过程 B、该过程中,CO先断键形成C和O,再生成CO2 C、状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2 D、状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用二、非选择题
-
24. 如图是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
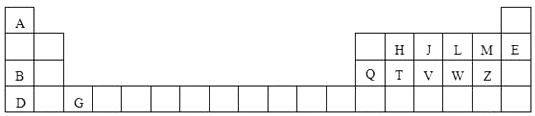 (1)、原子半径最大的元素是;在化合物中只有负价的元素是;属于副族元素是;适合作半导体材料的是 , (只用表中的字母填写)(2)、V在周期表中的位置第周期第族.(3)、A与M元素形成的化合物是化合物,D与Z原子形成的化学键是键;(4)、J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是;(用化学式表示)(5)、L元素形成的氢化物的在﹣4℃时是晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是 .(6)、写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式 .25. 按要求完成下列填空:(1)、 H、 H、 H互为 , 16O2、18O3互为 .
(1)、原子半径最大的元素是;在化合物中只有负价的元素是;属于副族元素是;适合作半导体材料的是 , (只用表中的字母填写)(2)、V在周期表中的位置第周期第族.(3)、A与M元素形成的化合物是化合物,D与Z原子形成的化学键是键;(4)、J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是;(用化学式表示)(5)、L元素形成的氢化物的在﹣4℃时是晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是 .(6)、写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式 .25. 按要求完成下列填空:(1)、 H、 H、 H互为 , 16O2、18O3互为 .A.同位素 B.相同物质
C.同素异形体 D.同分异构体
(2)、写出下列物质的电子式:①MgCl2; ②NaOH;
(3)、写出下列物质的结构式:①C2H2; ②H2O;
(4)、已知拆开1mol H﹣H键、1mol N﹣H键、1mol N≡N键分别需要的能量是436KJ、391KJ、946KJ,则N2与H2反应生成NH3的热化学方程式为 .26. 化学反应速率与限度与生产、生活密切相关(1)、A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):时间(min)
1
2
3
4
5
氢气体积(mL)(标准状况)
100
240
464
576
620
①反应速率最大的时间段是(指0~1、1~2、2~3、3~4、4~5 ) min,原因是 .
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 . (设溶液体积不变)
(2)、B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列 以减慢反应速率.(填写代号)A、蒸馏水 B、冰块 C、HNO3溶液 D、CuSO4溶液(3)、某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.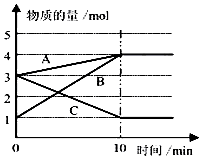
①该反应的化学方程式是 .
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率= ×100%】,请写出计算过程,计算结果保留1位小数)