2016-2017学年湖南省娄底市高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、单项选择题
-
1. 我国成功研制的铯(133Cs)原子钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒.已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( )A、23 B、55 C、78 D、1332. A由短周期元素和长周期元素共同组成的族可能是( )A、主族 B、副族 C、Ⅷ族 D、Ⅶ族3. 按钠、钾、铷、铯的顺序,下列有关叙述正确的是( )A、其氢氧化物中碱性最强的是NaOH B、单质还原能力最强的是铯 C、单质熔点最低的是钠 D、原子半径逐渐减少4. 下列有关碱金属元素的性质从上到下递变规律正确的是( )A、金属性逐渐增强 B、化合价逐渐升高 C、失电子能力逐渐减弱 D、最高价氧化物对应的水化物碱性逐渐减弱5. 下列物质中,既含有共价键又含有离子键的是( )A、HCl B、Na2S C、MgCl2 D、NaOH6. 下列化合物中阳离子半径与阴离子半径之比最大的是( )A、LiI B、NaBr C、KCl D、CsF7. 已知aXm+和bYn﹣两种离子的电子层结构相同,则b等于( )A、a+m+n B、a+m﹣n C、a﹣m+n D、a﹣m﹣n8. 元素X有质量数为79和81的两种同位素,现测得X元素的相对原子质量为79.9,则同位素81X在X元素中的质量分数是( )A、54.4% B、45.6% C、55% D、45%9. 下列关于卤族元素的说法正确的是( )A、F、Cl、Br、I最高正化合价都为+7 B、卤族元素的单质只有氧化性 C、从F到I,原子的得电子能力依次加强 D、卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由易变难10. 无放射性的同位素被称之为“稳定同位素”,在陆地生态系统研究中,2H、13C、15N、18O、34S等常作环境分析指示物.下列有关一些“稳定同位素”的说法错误的是( )A、34S原子核内中子数为18 B、2H+的酸性比1H+的酸性更强 C、16O与18O的化学性质几乎完全相同 D、13C和15N原子核内的质子数相差111. 实验室有下列各组反应物,放出氧气速率由快到慢排列正确的是( )
①0.2mol/L的H2O2溶液,25℃;②0.2mol/L的H2O2溶液,MnO2 , 25℃;
③0.2mol/L的H2O2溶液,35℃;④0.2mol/L的H2O2溶液,MnO2 , 35℃.
A、①②③④ B、④③②① C、②①③④ D、④②③①12. 下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( )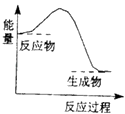 A、生石灰溶于水 B、高温条件下铝与氧化铁的反应 C、高温条件下碳粉与二氧化碳的反应 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应13. 下面是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,正确的是( )
A、生石灰溶于水 B、高温条件下铝与氧化铁的反应 C、高温条件下碳粉与二氧化碳的反应 D、Ba(OH)2•8H2O晶体与NH4Cl固体的反应13. 下面是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,正确的是( )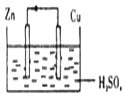 A、构成原电池的正极和负极的材料必须是两种金属 B、在该原电池中,铜作负极 C、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 D、铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过14. 100mL 6mol•L﹣1的 H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A、构成原电池的正极和负极的材料必须是两种金属 B、在该原电池中,铜作负极 C、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 D、铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过14. 100mL 6mol•L﹣1的 H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )①Na2CO3溶液 ②水 ③K2SO4溶液 ④CH3COONa 溶液 ⑤Na2SO4固体.
A、①②③ B、②③④ C、①②④ D、③④⑤15. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( ) A、化学方程式:2N⇌M B、t2时,正逆反应速率相等,达到平衡 C、t3时,正反应速率大于逆反应速率 D、t1时,M的浓度是N浓度的2倍16. 在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )A、四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) B、X、Y、Z、W形成的单质最多有6种 C、四种元素均可与氢元素形成18电子分子 D、四种元素中.Z的最高价氧化物对应水化物酸化最强
A、化学方程式:2N⇌M B、t2时,正逆反应速率相等,达到平衡 C、t3时,正反应速率大于逆反应速率 D、t1时,M的浓度是N浓度的2倍16. 在元素周期表短周期元素中,X元素与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20.下列判断正确的是( )A、四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) B、X、Y、Z、W形成的单质最多有6种 C、四种元素均可与氢元素形成18电子分子 D、四种元素中.Z的最高价氧化物对应水化物酸化最强二、填空题
-
17. 表是元素周期表的一部分,回答下列有关问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅤⅡA
0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
⑪
⑫
(1)、写出元素符号:⑨(填化学式,下同)(2)、在这些元素中,最活泼的金属元素是 .(3)、在这些元素的最高价氧化物对应水化物中,酸性最强的是 , 呈两性的氢氧化物是 .18. 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题: (1)、从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.(2)、在生产和生活中经常遇到化学能与电能的相互转化.
(1)、从能量的角度看,旧键断裂,新键形成必然有能量变化.已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”)kJ的热量.(2)、在生产和生活中经常遇到化学能与电能的相互转化.在如图甲、乙两装置中,甲中负极电极反应式为 , 溶液中的阴离子向极移动(填“Zn”或“Pt”);乙中铜电极作极,发生反应(填“氧化”或“还原”)
19. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: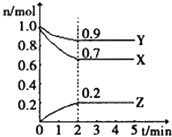 (1)、该反应在min时达到化学平衡状态.(2)、该反应的化学方程式是 .(3)、从开始到2min,Z的平均反应速率是 .20. 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
(1)、该反应在min时达到化学平衡状态.(2)、该反应的化学方程式是 .(3)、从开始到2min,Z的平均反应速率是 .20. 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题: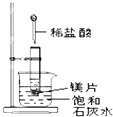 (1)、写出试管内反应的离子方程式;(2)、实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ , 产生上述现象Ⅲ的原因是 .(3)、由实验推知,MgCl2溶液和H2的总能量(填“大于”、“小于”或“等于”)镁片和盐酸的总能量.21. 现有A,B,C,D四种元素,A,B同周期,A,B可形成两种无色无味气体AB和AB2 . D在B的下一周期,其最高价氧化物的水化物是二元强酸,D,C可形成离子化合物CD,D离子比C离子多一个电子层.据此可知:(1)、这四种元素分别是A:_、B:、C:、D: .(2)、C离子的离子结构示意图是 .(3)、化合物CD的电子式是 .
(1)、写出试管内反应的离子方程式;(2)、实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ , 产生上述现象Ⅲ的原因是 .(3)、由实验推知,MgCl2溶液和H2的总能量(填“大于”、“小于”或“等于”)镁片和盐酸的总能量.21. 现有A,B,C,D四种元素,A,B同周期,A,B可形成两种无色无味气体AB和AB2 . D在B的下一周期,其最高价氧化物的水化物是二元强酸,D,C可形成离子化合物CD,D离子比C离子多一个电子层.据此可知:(1)、这四种元素分别是A:_、B:、C:、D: .(2)、C离子的离子结构示意图是 .(3)、化合物CD的电子式是 .三、计算题
-
22. 在一密闭的2L的容器里装有4mol SO2和2mol O2 , 在一定条件下开始反应.2min末测得容器中共有5.2mol 气体,试计算:(1)、2min末SO3气体的物质的量浓度;(2)、2min内O2的平均反应速率v(O2);(3)、2min末SO2的转化率.