2016-2017学年湖北省宜昌市部分示范高中联考高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、选择题:
-
1. 化学与生产、生活密切相关.下列有关叙述正确的是( )A、大气雾霾污染现象的产生与汽车尾气排放有关 B、玻璃和氮化硅陶瓷都属于新型无机非金属材料 C、活性炭与二氧化硫都可用于漂白,其漂白原理相同 D、空气中的臭氧对人体健康有益无害2. 下列说法不正确的是( )A、同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 B、非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 C、活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 D、将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成3. 下列离子方程式错误的是( )A、硅酸钠溶液中通入CO2气体:SiO32﹣+H2O+CO2═H2SiO3↓+CO32﹣ B、氯气与氢氧化钾溶液反应:Cl2+OH﹣═Cl﹣+ClO﹣+2H2O C、硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ D、小苏打溶液与稀盐酸反应:HCO3﹣+H+═H2O+CO2↑4. 关于 F﹣微粒叙述正确的是( )A、质量数为19,电子数为9 B、质子数为9,中子数为10 C、质子数为9,电子数为9 D、中子数为10,电子数为85. 下表符号中“2”的含义正确的一组是( )
H
2He
Cl2
Ca2+
A
质量数
中子数
质子数
电荷数
B
质量数
质子数
原子数
电荷数
C
质子数
中子数
原子数
电子数
D
质量数
质子数
分子数
电荷数
A、A B、B C、C D、D6. 已知原子序数为a的ⅡA族元素X和原子序数为b的ⅢA族元素Y位于元素周期表中同一周期,下列的量值关系不正确的是( )A、a=b﹣1 B、a=b﹣11 C、b=a+25 D、b=a+307. 在一定条件下,RO3﹣与R﹣可发生反应:RO3﹣+5R﹣+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )A、元素R位于周期表中第ⅤA族 B、RO3﹣中的R只能被还原 C、R2在常温常压下一定是气体 D、若1molRO3﹣参与该反应,则转移的电子的物质的量为5mol8. 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
A.由于 A、B两电极没有活动性差别,不能构成原电池 B、A电极是负极,电极上发生氧化反应 C、产物为无污染的水,属于环境友好的绿色电池 D、外电路中电流由B电极通过导线流向A电极9. 相同条件下,如果1mol氢原子所具有的能量为E1 , 1mol氢分子的能量为E2 . 下列关系中正确的是( )A、2E1=E2 B、2E1>E2 C、2E1<E2 D、E1=E210. 下列各项中表达正确的是( )A、H、D、T表示同一种核素 B、F﹣离子结构示意图
A、B两电极没有活动性差别,不能构成原电池 B、A电极是负极,电极上发生氧化反应 C、产物为无污染的水,属于环境友好的绿色电池 D、外电路中电流由B电极通过导线流向A电极9. 相同条件下,如果1mol氢原子所具有的能量为E1 , 1mol氢分子的能量为E2 . 下列关系中正确的是( )A、2E1=E2 B、2E1>E2 C、2E1<E2 D、E1=E210. 下列各项中表达正确的是( )A、H、D、T表示同一种核素 B、F﹣离子结构示意图 C、次氯酸电子式
C、次氯酸电子式 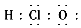 D、用电子式表示HCl形成过程
D、用电子式表示HCl形成过程 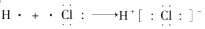 11. 下面是某同学完成的探究实验报告的一部分:
11. 下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸.
实验设计如下
实验步骤
实验结论
①氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色
氧化性从强到弱的顺序:氯、溴、碘
②NaBr溶液+氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色
③KI溶液+氯水+1 mL CCl4 , 振荡,静置,观察四氯化碳层颜色
下列有关该实验的说法不正确的是( )
A、完成该实验需用到的实验仪器有试管和胶头滴管 B、CCl4在实验中所起的作用是萃取剂 C、③中反应的离子方程式为Cl2+2I﹣═2Cl﹣+I2 D、上述三步实验能很好的探究卤素单质的氧化性强弱12. 类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )A、SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 B、常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 C、SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 D、盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气13. 在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol•L﹣1和0.1mol•L﹣1 . 向该混合液中加入1.92g铜粉,加热,待充分反应后,设溶液的体积仍为100mL,则所得溶液中的Cu2+的物质的量浓度是( )A、0.15 mol•L﹣1 B、0.225 mol•L﹣1 C、0.35 mol•L﹣1 D、0.45 mol•L﹣114. 日常所用干电池的电极分别为石墨棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2),电极反应式可简化为:Zn﹣2e﹣=Zn2+ , 2NH4++2e﹣=2NH3↑+H2↑(NH3与Zn2+能生成一种稳定的物质).根据上述判断,下列结论正确的是( )①锌为正极,石墨为负极②锌为负极,石墨为正极③工作时,电子由石墨极经过外电路流向锌极④长时间连续使用时,内装糊状物可能流出腐蚀用电器.
A、①③ B、②③ C、③④ D、②④15. 下列所列各物质的用途中,不正确的是( )A、硅酸:粘合剂、耐火材料 B、硅胶:干燥剂、吸附剂、催化剂载体 C、碳化硅:砂纸、砂轮 D、分子筛:吸附剂、催化剂16. 表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.102
0.074
主要化合价
+2
+3
+2
+6、﹣2
﹣2
A、氢化物的稳定性为H2T<H2R B、M与T形成的化合物既能与强酸反应又能与强碱反应 C、L2+与R2﹣的核外电子数相等 D、单质分别与浓度相等的稀盐酸反应的速率为Q>L17. 已知氨气极易溶于水,而难溶于有机溶剂CCl4(密度大于水).下列装置中不适宜作NH3的尾气吸收的是( )A、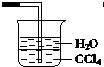 B、
B、 C、
C、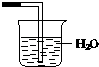 D、
D、 18. 课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使红色石蕊试纸变蓝.由该实验能够得到的正确结论是( )
18. 课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使红色石蕊试纸变蓝.由该实验能够得到的正确结论是( ) A、原溶液中一定含有SO42﹣离子 B、原溶液中一定含有NH4+离子 C、原溶液中一定含有Cl﹣离子 D、原溶液中一定含有Fe3+离子
A、原溶液中一定含有SO42﹣离子 B、原溶液中一定含有NH4+离子 C、原溶液中一定含有Cl﹣离子 D、原溶液中一定含有Fe3+离子二、非选择题部分
-
19. 已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:
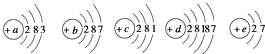
请回答下列问题:
(1)、属于同周期的元素是(填元素符号,下同),属于同主族的元素 .(2)、金属性最强的元素是 , 非金属性最强的元素是 .(3)、上述元素中最高价氧化物对应的水化物碱性最强的是 .20. 根据问题填空:(1)、实验室用金属铜和稀硝酸制取NO的离子方程式: .(2)、NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图Ⅰ所示.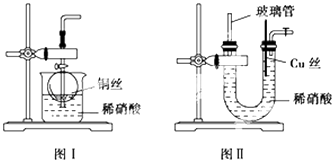
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是(填选项编号).
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是 (填化学方程式)
(3)、为了证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图Ⅱ所示制取NO的装置.反应开始后,可以在U形管右端观察到无色的NO气体.①长玻璃管的作用是 .
②让反应停止的操作方法及原因是 .
(4)、以下收集NO气体的装置(见图Ⅲ),合理的是(填选项代号) 21. 关于X、Y、Z三种元素,有以下五点信息
21. 关于X、Y、Z三种元素,有以下五点信息①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z﹣ , 其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性.
(1)、试写出Z的元素符号;化合物XZ的电子式: , X2Y的结构式 .(2)、用电子式表示XZ的形成过程 .(3)、写出信息⑤中的化学方程式 .(4)、X2、Y2和KOH溶液一起可以构成新型燃料电池,写出该电池的总反应方程式: .(5)、已知拆开1mol X﹣X键、1mol Z﹣Z键、1mol X﹣Z键分别需要吸收的能量为436KJ、243KJ、432KJ,计算反应X2(g)+Z2(g)=2XZ(g)的△H=KJ/mol.22. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.(1)、Ⅰ.将钠、镁、铝各1 mol分别投入到足量同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应产生的气体最多(填名称).(2)、向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:(3)、Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律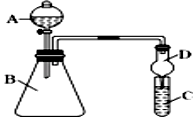
仪器A的名称为 , 干燥管D的作用为 .
(4)、若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉﹣碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气,此吸收反应的离子方程式;(5)、若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C 中干扰试验,应在两装置间添加装有溶液的洗气瓶除去.