2016-2017学年湖北省孝感市七校联考高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、单项选择
-
1. 判断下列元素中不属于主族元素的是( )A、硫 B、铁 C、钙 D、硅2. 中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝.关于 Lv的叙述错误的是( )A、原子序数116 B、中子数177 C、核外电子数116 D、质子数1773. X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
 A、原子半径:Y>Z>X B、气态氢化物的热稳定性:X<Z C、y和z的最高价氧化物对应水化物均为强酸 D、若z的最高正价为+m,则X的最高正价也一定为+m4. 下列关于化学键的说法中不正确的是( )A、化学键是一种作用力 B、化学键可以使原子相结合,也可以使离子相结合 C、化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 D、极性键不是一种化学键5. 下列说法正确的是( )
A、原子半径:Y>Z>X B、气态氢化物的热稳定性:X<Z C、y和z的最高价氧化物对应水化物均为强酸 D、若z的最高正价为+m,则X的最高正价也一定为+m4. 下列关于化学键的说法中不正确的是( )A、化学键是一种作用力 B、化学键可以使原子相结合,也可以使离子相结合 C、化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 D、极性键不是一种化学键5. 下列说法正确的是( )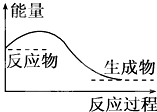 A、任何化学反应都伴随着能量的变化 B、H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 C、化学反应中能量的变化都表现为热量的变化 D、对于如图所示的过程,是吸收能量的过程6. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、铝片与稀盐酸的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、灼热的炭与CO2的反应 D、甲烷在氧气中的燃烧反应7. 下列有关化学用语表示正确的是( )A、CO2的比例模型:
A、任何化学反应都伴随着能量的变化 B、H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化 C、化学反应中能量的变化都表现为热量的变化 D、对于如图所示的过程,是吸收能量的过程6. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、铝片与稀盐酸的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、灼热的炭与CO2的反应 D、甲烷在氧气中的燃烧反应7. 下列有关化学用语表示正确的是( )A、CO2的比例模型: B、氢氧根离子的电子式:
B、氢氧根离子的电子式:  C、氯原子的结构示意图:
C、氯原子的结构示意图: 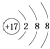 D、中子数为146、质子数为92的铀(U)原子: U
8. 根据元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )A、非金属性:F>S>Cl B、原子半径:Cl>S>F C、稳定性:HF>HCl>H2S D、酸性:HClO4>H2SO49. 下列物质中,有非极性键的是( )A、氮气 B、氯化镁 C、水 D、甲烷10. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左、下方区域的金属元素 B、金属元素和非金属分界线附近的元素 C、右、上方区域的非金属元素 D、稀有气体元素11. 元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )A、11和16 B、6和8 C、12和17 D、20和812. 依据元素周期表及元素周期律,下列推断中正确的是( )A、同一周期元素的原子,半径越小越容易失去电子 B、ⅠA族元素的金属性比ⅡA族元素的金属性强 C、向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 D、主族元素的最高正化合价等于该元素原子的核外电子数13. 已知An+、B(n+1)+、Cn﹣、D(n+1)﹣具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )A、气态氢化物的稳定性:D>C B、原子序数:B>A>C>D C、最高价氧化物对应水化物的碱性:B>A D、四种元素一定都属于短周期元素14. 钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的
D、中子数为146、质子数为92的铀(U)原子: U
8. 根据元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )A、非金属性:F>S>Cl B、原子半径:Cl>S>F C、稳定性:HF>HCl>H2S D、酸性:HClO4>H2SO49. 下列物质中,有非极性键的是( )A、氮气 B、氯化镁 C、水 D、甲烷10. 元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )A、左、下方区域的金属元素 B、金属元素和非金属分界线附近的元素 C、右、上方区域的非金属元素 D、稀有气体元素11. 元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是( )A、11和16 B、6和8 C、12和17 D、20和812. 依据元素周期表及元素周期律,下列推断中正确的是( )A、同一周期元素的原子,半径越小越容易失去电子 B、ⅠA族元素的金属性比ⅡA族元素的金属性强 C、向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 D、主族元素的最高正化合价等于该元素原子的核外电子数13. 已知An+、B(n+1)+、Cn﹣、D(n+1)﹣具有相同的电子层结构.下列关于A、B、C、D四种元素的叙述中正确的是( )A、气态氢化物的稳定性:D>C B、原子序数:B>A>C>D C、最高价氧化物对应水化物的碱性:B>A D、四种元素一定都属于短周期元素14. 钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的是( )
A、其单质的熔点比钠的熔点低 B、其氧化物对应的水化物的碱性很强 C、其原子半径在同一主族中是最大的 D、在空气中燃烧只能生成Fr2O15. 下列说法正确的是( )A、Li在氧气中燃烧主要生成Li2O2 B、At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 C、卤族元素单质的熔、沸点随原子序数的增大而升高 D、第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性16. 下列事实不能作为实验判断依据的是( )A、钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg B、铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na C、酸性H2CO3<H2SO4 , 判断硫与碳的非金属性强弱:S>C D、F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl二、填空题
-
17. 用序号回答:①HCl ②NaOH ③Cl2④H2O ⑤NH4Cl ⑥P4⑦Na2O2(1)、存在离子键的是(2)、属于共价化合物的是(3)、存在极性键的是(4)、存在非极性键的是 .18. A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质 子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍.(1)、试推断它们各是什么元素,写出它们的元素符号:A , B , C , D .(2)、画出D的离子结构示意图 .(3)、由这四种元素组成的三核10电子的分子为 , 四核10电子的分子是 .19. 如图是元素周期表的一部分.

根据表中元素的位置,回答下列问题:
(1)、元素②最外层有个电子,最低负化合价为 .(2)、元素③、④、⑦的简单离子中,半径最小的是(填离子符号,下同),半径最大的是 .(3)、元素②、⑥的单质与元素①的单质反应生成的化合物中,(填化学式)更稳定,①、②形成的另一 种化合物可用于漂白,是利用其 .(4)、实验室中,元素⑤的氢氧化物可由铝盐与反应生成,其氢氧化物能溶于表中(填序号) 的最高价氧化物对应的水化物中.20. 某研究性学习小组设计了一组实验来验证元素周期律.用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.
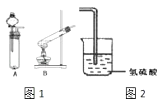 (1)、过氧化氢的电子式:;(2)、从图1中选择氧气的制备装置 , 反应前需要的操作是:;(3)、该实验如何证明O的非金属性强于S(用化学方程式表示);(4)、你认为能证明Cl的非金属性强于S的是
(1)、过氧化氢的电子式:;(2)、从图1中选择氧气的制备装置 , 反应前需要的操作是:;(3)、该实验如何证明O的非金属性强于S(用化学方程式表示);(4)、你认为能证明Cl的非金属性强于S的是a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈.
21. A,B,C,D,E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C,B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个,C是短周期元素原子半径最大的元素,E是地壳中含量最高的金属元素.根据以上信息回答下列问题:
(1)、D元素在周期表中的位置是;(2)、A单质的结构式;(3)、乙物质中含有的化学键类型为;(4)、A,B,C,D,E五种元素的原子半径由小到大的顺序是(用元素符号填写) .(5)、E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是 .