2016-2017学年湖北省天门市三校联考高一下学期期中化学试卷
试卷更新日期:2017-07-18 类型:期中考试
一、一.选择题
-
1. 导致下列现象的主要原因与排放SO2有关的是( )A、酸雨 B、光化学烟雾 C、臭氧空洞 D、温室效应2. 下列物质的名称或化学式与颜色不一致的是( )A、过氧化钠(淡黄色) B、NO2(红棕色) C、NO(无色) D、铁锈(黑色)3. 14C可用于考古,“14”是指( )A、质量数 B、核外电子数 C、中子数 D、质子数4. 下列过程中,需要增大化学反应速率的是( )A、钢铁腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨5. 许多国家十分重视海水资源的综合利用.不需要化学变化就能够从海水中获得的物质是( )A、氯、溴、碘 B、钠、镁、铝 C、食盐、淡水 D、烧碱、氢气6. 已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )A、原子半径:Sr>Ca B、最高化合价为+2 C、8838Sr的中子数为38 D、氢氧化物为强碱7. 碱金属是典型的活泼金属,其根本原因是( )A、碱金属原子最外电子层上都只有1个电子,容易失去 B、碱金属在常温下易被氧化 C、碱金属单质的密度小,熔点和沸点低 D、碱金属原子的核电荷数比较小8. A和B均为短周期元素,它们的离子A﹣和B2+具有相同的核外电子层结构.下面说法正确的是( )A、原子序数A>B B、核外电子数为B>A C、原子半径A>B D、离子半径 B2+>A﹣9. 决定化学反应速率的主要因素是( )A、反应物本身的性质 B、催化剂 C、温度 D、压强10. 下列分子中所有原子都满足最外层为8电子结构的是( )A、SiCl4 B、H2O C、BF3 D、PCl511. 下列反应中,硫酸既表现出强氧化性,又表现出酸性的是( )A、稀硫酸与锌粒反应生成气体 B、浓硫酸使铁、铝钝化 C、浓硫酸与铜反应加热反应产生SO2 D、浓硫酸和木炭在加热条件下反应12. 下列物质的转化必须加入氧化剂且通过一步反应就能完成的是( )
①NO2→NO ②NO2→HNO3③N2→NO2④N2→NO ⑤N2→NH3 .
A、① B、②⑤ C、④ D、③④13. 已知:2SO2+O2═2SO3为放热反应,对该反应的下列说法中正确的是( )A、SO2的能量一定高于SO3的能量 B、因该反应为放热反应,故不必加热就可发生 C、O2的能量一定高于SO2的能量 D、SO2和O2的总能量一定高于SO3的总能量14. 下列反应属于放热反应的是( )A、氢氧化钡晶体和氯化铵晶体的反应 B、能量变化如图所示的反应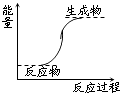 C、化学键断裂吸收的热量比化学键生成放出的热量多的反应
D、燃烧反应和中和反应
15. X、Y、Z三种短周期元素在周期表中的位置如图所示.若这三种元素的原子序数之和为32,则Y元素是( )
C、化学键断裂吸收的热量比化学键生成放出的热量多的反应
D、燃烧反应和中和反应
15. X、Y、Z三种短周期元素在周期表中的位置如图所示.若这三种元素的原子序数之和为32,则Y元素是( ) A、碳 B、硫 C、氧 D、氯16. 下列各组中每种物质都既有离子键又有共价键的一组是( )A、NaOH、H2SO4、(NH4)2SO4 B、Ba(OH)2、Na2SO4、Na3PO4 C、Na2CO3、HNO3、MgO D、HCl、Al2O3、MgCl217. 在N2+3H2⇌2NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 mol•L﹣1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )A、0.3 mol•L﹣1•S﹣1 B、0.4 mol•L﹣1•S﹣1 C、0.6mol•L﹣1•S﹣1 D、0.8 mol•L﹣1•S﹣118. 已知元素X,Y的核电荷数分别是a和b,它们的离子Xm+和Yn﹣的核外电子排布相同,则下列关系式中正确的是( )A、a=b+m+n B、a=b﹣m+n C、a=b+m﹣n D、a=b﹣m﹣n
A、碳 B、硫 C、氧 D、氯16. 下列各组中每种物质都既有离子键又有共价键的一组是( )A、NaOH、H2SO4、(NH4)2SO4 B、Ba(OH)2、Na2SO4、Na3PO4 C、Na2CO3、HNO3、MgO D、HCl、Al2O3、MgCl217. 在N2+3H2⇌2NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 mol•L﹣1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )A、0.3 mol•L﹣1•S﹣1 B、0.4 mol•L﹣1•S﹣1 C、0.6mol•L﹣1•S﹣1 D、0.8 mol•L﹣1•S﹣118. 已知元素X,Y的核电荷数分别是a和b,它们的离子Xm+和Yn﹣的核外电子排布相同,则下列关系式中正确的是( )A、a=b+m+n B、a=b﹣m+n C、a=b+m﹣n D、a=b﹣m﹣n二、二.非选择题
-
19. 填空题(1)、I.比较原子半径的大小:OF;(填“>”或“<”,下同)(2)、比较酸性强弱:H3PO4H2SiO3(3)、稳定性:NH3PH3(4)、II.写出下列物质形成过程的电子式:
HCl
(5)、MgCl2 .20.为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:
 (1)、写出实验室制取氨气的化学方程式 .(2)、要得到干燥的氨气可选用 作干燥剂.A、碱石灰(CaO和NaOH的混合物) B、浓硫酸 C、浓硝酸 D、氢氧化钠溶液(3)、用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是 .21. 填空题(1)、浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的是(可多选,但只要有选错项,即得0分)
(1)、写出实验室制取氨气的化学方程式 .(2)、要得到干燥的氨气可选用 作干燥剂.A、碱石灰(CaO和NaOH的混合物) B、浓硫酸 C、浓硝酸 D、氢氧化钠溶液(3)、用如图装置进行喷泉实验,烧瓶中已装满干燥氨气,引发水上喷的操作是 .21. 填空题(1)、浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的是(可多选,但只要有选错项,即得0分)①Cl2②H2S ③CO2④NH3
(2)、浓H2SO4能使纸片变黑,是由于它具有性;(3)、浓H2SO4可以与Cu反应,是由于它具有强氧化性和性,化学学方程式是: .22. 化学反应中的能量变化是人类获取能量的重要途径.(1)、液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是(填字母).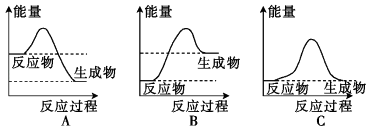 (2)、“冰袋”可用于短时间保鲜食物.将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”.使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温.由此判断:反应后生成产物的总能量(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量.(3)、化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化.比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和;人们普遍使用的干电池工作时是将化学能转化为 .
(2)、“冰袋”可用于短时间保鲜食物.将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”.使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温.由此判断:反应后生成产物的总能量(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量.(3)、化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化.比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和;人们普遍使用的干电池工作时是将化学能转化为 .