2017年山东省滨州市七校联考中考化学模拟试卷(二)
试卷更新日期:2017-07-18 类型:中考模拟
一、选择题
-
1. 人体中发生的以下变化属于物理变化的是( )A、汗水的挥发 B、蛋白质的水解 C、葡萄糖的氧化 D、油脂的消化吸收2. 下列物质中富含糖类的是( )A、豆腐 B、玉米 C、奶油 D、黄瓜3. 下列有关化学概念理解正确的是( )A、氯化钠在20℃时的溶解度是36g,则100g的氯化钠溶液中含有氯化钠36g B、含氧元素的化合物一定是氧化物 C、氧化反应一定是化合反应 D、化合物一定是由不同种元素组成的4. 图示“错误操作”与图下面“可能产生的后果”不一致的是( )A、
 标签受损
B、
标签受损
B、 试剂污染
C、
试剂污染
C、 液滴飞溅
D、
液滴飞溅
D、 读数偏小
5. 下列有关钠在氯气中燃烧的实验,分析合理的是( )A、钠在氯气中燃烧时,钠原子得到电子 B、反应物钠由分子构成,生成物氯化钠由离子构成 C、钠能在氯气中燃烧,说明燃烧不一定需要氧气参与 D、钠在氯气中燃烧生成的氯化钠与家庭中食用的氯化钠化学性质不同6. 采取正确的措施,能够避免火灾发生或减少灾害损失,下列灭火方法不恰当的是( )A、油锅起火﹣用锅盖盖灭 B、酒精灯着火﹣用湿抹布盖灭 C、森林起火﹣砍伐树木形成隔离带 D、汽车油箱着火﹣用水浇灭7. 下列实验操作不能达到实验目的是( )
读数偏小
5. 下列有关钠在氯气中燃烧的实验,分析合理的是( )A、钠在氯气中燃烧时,钠原子得到电子 B、反应物钠由分子构成,生成物氯化钠由离子构成 C、钠能在氯气中燃烧,说明燃烧不一定需要氧气参与 D、钠在氯气中燃烧生成的氯化钠与家庭中食用的氯化钠化学性质不同6. 采取正确的措施,能够避免火灾发生或减少灾害损失,下列灭火方法不恰当的是( )A、油锅起火﹣用锅盖盖灭 B、酒精灯着火﹣用湿抹布盖灭 C、森林起火﹣砍伐树木形成隔离带 D、汽车油箱着火﹣用水浇灭7. 下列实验操作不能达到实验目的是( )选项
实验目的
实验操作
A
鉴别NaOH和NaCl固体
分别加少量水溶液
B
鉴别棉线和羊毛线
点燃后闻气味
C
除去H2中少量的水蒸气
将混合气体通过装有浓硫酸的洗气瓶
D
检验Na2CO3溶液中是否混有NaCl
加入过量的稀盐酸后,再滴加硝酸银溶液
A、A B、B C、C D、D8. 下列关于化学方程式4P+5O2 2P2O5的读法,错误的是( )A、磷和氧气在点燃的条件下反应生成五氧化二磷 B、在点燃的条件下,每4体积的磷和5体积的氧气完全反应,生成五氧化二磷 C、在点燃的条件下,每4个磷原子和5个氧气分子结合生成2个五氧化二磷分子 D、在点燃的条件下,每124份质量的磷和160份质量的氧气完全反应,生成284份质量的五氧化二磷9. 下列实验设计或结论合理的是( )A、向某固体滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 B、除去MgCl2溶液中混有的少量CuCl2 , 可加入适量的Mg(OH)2 , 充分搅拌后过滤 C、CO32﹣、Na+、NO3﹣、K+四种离子可在pH=12的溶液中大量共存 D、将带火星的木条伸入到装有气体的集气瓶中,木条不复燃,证明该气体中不含氧气10. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、 B、
B、 C、
C、 D、
D、 11. 现有32g某可燃物在密闭容器中完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是( )A、一定是氧化物 B、只含有碳、氢两种元素 C、一定含有碳、氢、氧三种元素 D、一定含有碳、氢元素,可能含有氧元素12. 下列各组离子,在溶液中能大量共存的是( )A、Cu2+、NH4+、NO3﹣、OH﹣ B、H+、Na+、HCO3﹣、Cl﹣ C、Ba2+、Ag+、Cl﹣、CO32﹣ D、K+、Mg2+、NO3﹣、SO42﹣13. 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中
11. 现有32g某可燃物在密闭容器中完全燃烧后,测得生成88g二氧化碳和72g水,关于该可燃物的说法正确的是( )A、一定是氧化物 B、只含有碳、氢两种元素 C、一定含有碳、氢、氧三种元素 D、一定含有碳、氢元素,可能含有氧元素12. 下列各组离子,在溶液中能大量共存的是( )A、Cu2+、NH4+、NO3﹣、OH﹣ B、H+、Na+、HCO3﹣、Cl﹣ C、Ba2+、Ag+、Cl﹣、CO32﹣ D、K+、Mg2+、NO3﹣、SO42﹣13. 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子,○代表一个氢原子,
代表一个碳原子,○代表一个氢原子,  代表一个氧原子,下列说法不正确的是( )
代表一个氧原子,下列说法不正确的是( )  A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:114. 如图表示甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )
A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:114. 如图表示甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( ) A、t2℃时,甲、乙溶液中溶质质量分数一定相等 B、乙中含有少量甲,可采用降温结晶的方法提纯乙 C、t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>丙>甲 D、t2℃时,100g甲的饱和溶液中加入400g水,得到10%的甲溶液15. 下列四组物质,从左至右都能发生化学反应的是( )
A、t2℃时,甲、乙溶液中溶质质量分数一定相等 B、乙中含有少量甲,可采用降温结晶的方法提纯乙 C、t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>丙>甲 D、t2℃时,100g甲的饱和溶液中加入400g水,得到10%的甲溶液15. 下列四组物质,从左至右都能发生化学反应的是( )(如:a+b﹣反应 b+c﹣反应 c+d﹣反应)
a
b
c
d
①
CO2
NaOH溶液
CuSO4溶液
Fe
②
稀盐酸
Na2CO3溶液
CaCl2溶液
CO2
③
AgNO3溶液
BaCl2溶液
稀硫酸
Fe2O3
④
Zn
稀盐酸
NH4NO3溶液
Ca(OH)2溶液
A、①②③ B、①③④ C、①③ D、①②③④16. 如表中,有关量的变化图象与其对应叙述相符的是( )A、 向接近饱和的NaCl溶液中加入固体NaCl
B、
向接近饱和的NaCl溶液中加入固体NaCl
B、 向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2
C、
向等质量、等质量分数的两份稀盐酸中分别加入足量的ZnO和Zn(OH)2
C、 向Na2CO3溶液中加入一定溶质质量分数的NaOH溶液
D、
向Na2CO3溶液中加入一定溶质质量分数的NaOH溶液
D、 等质量、等质量分数的H2SO4溶液与NaOH溶液混合
等质量、等质量分数的H2SO4溶液与NaOH溶液混合
二、解答题
-
17. 原子序数为1﹣18的元素的原子结构示意图等信息如图,请认真并回答下列问题.
 (1)、原子序数为12的元素位于元素周期表中第周期,它属于(填“金属”或“非金属”)元素.(2)、在化学反应中,原子序数为16的元素的原子容易(填“得到”或“失去”)电子,所形成的粒子的符号是 .(3)、根据氟原子结构示意图分析,氟元素与的化学性质相似.(4)、同周期元素,从左到右,各元素原子随原子序数的增加,18. 碳及其化合物与人类关系密切,在生活中应用广泛,请填写下列空格:(1)、下列含碳元素的物质:①碳酸钠 ②甲烷 ③一氧化碳 ④碳酸,属于有机物的是(填序号,下同),汽水中含有的一种酸是 .(2)、木炭可以做燃料,它在空气中充分燃烧的化学方程式是 .(3)、倡导“低碳”生活,主要是为了减少的排放量,请写出一例符合这一主题的做法19. 焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5 .
(1)、原子序数为12的元素位于元素周期表中第周期,它属于(填“金属”或“非金属”)元素.(2)、在化学反应中,原子序数为16的元素的原子容易(填“得到”或“失去”)电子,所形成的粒子的符号是 .(3)、根据氟原子结构示意图分析,氟元素与的化学性质相似.(4)、同周期元素,从左到右,各元素原子随原子序数的增加,18. 碳及其化合物与人类关系密切,在生活中应用广泛,请填写下列空格:(1)、下列含碳元素的物质:①碳酸钠 ②甲烷 ③一氧化碳 ④碳酸,属于有机物的是(填序号,下同),汽水中含有的一种酸是 .(2)、木炭可以做燃料,它在空气中充分燃烧的化学方程式是 .(3)、倡导“低碳”生活,主要是为了减少的排放量,请写出一例符合这一主题的做法19. 焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5 .已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5
 (1)、图中盛放浓硫酸的仪器名称是;(2)、写出C中发生反应的化学方程式;(3)、在实验过程中,滴加浓硫酸不宜过快,理由是 .(4)、该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的有关(填化学性质)20. 海水中含有丰富的镁,目前世界上生成的镁60%来自于海水.分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2 . 工业上以苦卤水为原料制取金属镁的流程如图:
(1)、图中盛放浓硫酸的仪器名称是;(2)、写出C中发生反应的化学方程式;(3)、在实验过程中,滴加浓硫酸不宜过快,理由是 .(4)、该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的有关(填化学性质)20. 海水中含有丰富的镁,目前世界上生成的镁60%来自于海水.分离出食盐的海水称作苦卤水,其中含有丰富的MgCl2 . 工业上以苦卤水为原料制取金属镁的流程如图: (1)、写出沉淀槽中发生反应的化学方程式 , .(2)、Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的循环利用,则Z的化学式为 , X溶液的名称是(3)、烘干后得到的MgCl2中可能含有的杂质是 .21. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题.
(1)、写出沉淀槽中发生反应的化学方程式 , .(2)、Y与Z反应后的产物溶于水可得X溶液,从而实现了Y的循环利用,则Z的化学式为 , X溶液的名称是(3)、烘干后得到的MgCl2中可能含有的杂质是 .21. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法,请结合如图所示的氢氧化钠溶液和稀硫酸反应的微观示意图,回答下列问题. (1)、写出氢氧化钠溶液和稀硫酸反应的化学方程式 .(2)、写出图中C方框内甲、乙两种粒子的符号:甲 , 乙(3)、从微观的角度分析,上述反应的实质是(填粒子符号,下同)和结合成H2O.22. 有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质祖成,为探究该样品的组成,某小组取适量样品按下列流程进行实验.
(1)、写出氢氧化钠溶液和稀硫酸反应的化学方程式 .(2)、写出图中C方框内甲、乙两种粒子的符号:甲 , 乙(3)、从微观的角度分析,上述反应的实质是(填粒子符号,下同)和结合成H2O.22. 有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质祖成,为探究该样品的组成,某小组取适量样品按下列流程进行实验.
请回答下列问题:
(1)、过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 , 其中玻璃棒的作用是 .(2)、滤渣a的成分是 , 滤液中溶质的成分除氯化钠还有 , 白色沉淀b的成分是 .(3)、若现象①“滤渣全部溶解”变为“滤渣部分溶解”,其他现象不变,则原样品中不能确定是否存在的物质是 .三、解答题
-
23. 实验是进行科学探究的重要方式,某同学设计如图所示实验,探究二氧化碳的有关性质.请填空:
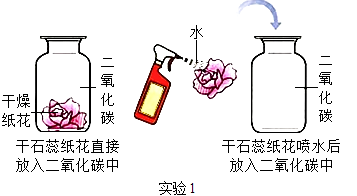 (1)、实验1采用科学探究中的控制变量法,该实验控制的变量是 .(2)、实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是 , 该反应的化学方程式是 .(3)、实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第(填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是 .
(1)、实验1采用科学探究中的控制变量法,该实验控制的变量是 .(2)、实验1中干石蕊纸花喷水后放入二氧化碳中,观察到的现象是 , 该反应的化学方程式是 .(3)、实验2是在实验1的基础上设计的创新改进实验,将二氧化碳缓慢通入竖直放置的玻璃管中,能观察到第(填序号)号棉球先变色,通过此现象可获得关于二氧化碳的另外一条性质是 . 24. 以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格).
24. 以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格).【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等; 猜想2:相等.
(1)、【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量.甲 组
乙 组
实验
方案
(反应后略)


实验
现象
有气泡产生,
天平指针向右偏转
铁钉表面有红色物质析出,
溶液颜色发生改变,
天平指针没有偏转
结论
猜想1正确
反应的化学方程式:
猜想2正确
(2)、【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转.得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在中进行.(3)、【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是(填序号),从另外两种装置中任选一种指出其不足 . (4)、【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确.进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:的各物质的质量总和等于反应后生成的各物质的质量总和.(5)、【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒.
(4)、【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确.进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:的各物质的质量总和等于反应后生成的各物质的质量总和.(5)、【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒.应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由种元素组成.
四、解答题
-
25. 将19.45克碳酸钠和氯化钠的固体混合物放置于烧杯(重50克)中,加入一定量的水,固体全部溶解,然后向烧杯中滴加一定溶质质量分数的稀盐酸,实验测得烧杯及杯中物质的总质量与加入稀盐酸的质量关系如图所示.计算:
 (1)、所加稀盐酸的溶质质量分数(2)、恰好完全反应时所得溶液的溶质质量分数.
(1)、所加稀盐酸的溶质质量分数(2)、恰好完全反应时所得溶液的溶质质量分数.