浙江省温州十五校联合体2019-2020学年高二上学期化学期中考试试卷
试卷更新日期:2019-11-18 类型:期中考试
一、单选题
-
1. 下列物质属于强电解质的是( )A、盐酸 B、水玻璃 C、铜 D、碳酸钙2. 下图所示实验设计能达到相应的实验目的的是( )A、从水中萃取碘
 B、收集H2或CO2
B、收集H2或CO2  C、高温煅烧石灰石
C、高温煅烧石灰石  D、稀释浓硫酸
D、稀释浓硫酸  3. 下列反应既是氧化还原反应,又是吸热反应的是( )A、铝热反应 B、Ba(OH)2·8H2O与NH4Cl的反应. C、钠与水的反应 D、绿色植物的光合作用4. 化学反应速率的大小主要取决于( )A、反应物的性质 B、温度 C、反应物的浓度 D、催化剂5. 下列化学用语正确的是( )A、蔗糖的分子式:C12H24O12 B、氯化铵的电子式:
3. 下列反应既是氧化还原反应,又是吸热反应的是( )A、铝热反应 B、Ba(OH)2·8H2O与NH4Cl的反应. C、钠与水的反应 D、绿色植物的光合作用4. 化学反应速率的大小主要取决于( )A、反应物的性质 B、温度 C、反应物的浓度 D、催化剂5. 下列化学用语正确的是( )A、蔗糖的分子式:C12H24O12 B、氯化铵的电子式: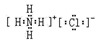 C、HClO的结构式:H—Cl—O
D、四氯化碳的比例模型:
C、HClO的结构式:H—Cl—O
D、四氯化碳的比例模型:  6. 下列说法正确的是( )A、足球烯C60具有很多优异的性能,有很高的熔沸点 B、SiO2可用来制造光导纤维,是因为SiO2是原子晶体,硬度大 C、工业上可用淀粉、纤维素为原料生产葡萄糖 D、工业上通过电解熔融的MgO制金属镁7. 已知NA是阿伏加德罗常数的值,下列说法错误的是( )A、3g 3He含有的中子数为1NA B、0.1 mol·L−1碳酸钠溶液含有的CO32—数目为0.1NA C、25℃,1.01×105Pa时,22.4LCO2中含有的氧原子数目小于2NA D、a g正丁烷和b g异丁烷的混合物中共价键数目为13(a+b)NA/588. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
6. 下列说法正确的是( )A、足球烯C60具有很多优异的性能,有很高的熔沸点 B、SiO2可用来制造光导纤维,是因为SiO2是原子晶体,硬度大 C、工业上可用淀粉、纤维素为原料生产葡萄糖 D、工业上通过电解熔融的MgO制金属镁7. 已知NA是阿伏加德罗常数的值,下列说法错误的是( )A、3g 3He含有的中子数为1NA B、0.1 mol·L−1碳酸钠溶液含有的CO32—数目为0.1NA C、25℃,1.01×105Pa时,22.4LCO2中含有的氧原子数目小于2NA D、a g正丁烷和b g异丁烷的混合物中共价键数目为13(a+b)NA/588. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )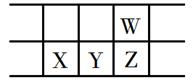 A、原子半径:Y>W B、Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态 C、最低价氢化物的沸点:W<Z D、X的最高价氧化物的水化物既能与酸反应又能与碱反应9. 下列离子反应方程式正确的是( )A、AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B、NO2溶于水:3NO2+H2O=2H++2NO3-+NO C、Na2O2与水反应: 2O22-+2H2O=4OH-+O2↑ D、硝酸银溶液中放入铁粉:Ag+ + Fe = Fe2+ + Ag10. 下列各组离子在指定溶液中一定能大量共存的是( )A、1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- B、甲基橙呈红色的溶液:H+、Ba2+、AlO2-、Cl- C、pH=12的溶液:K+、Na+、CH3COO-、Br- D、与铝反应产生大量氢气的溶液:Na+、K+、NH4+、SO42-11. 将0.195克锌粉加入到20.0mL的0.100 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物(只有一种)是( )A、M B、M+ C、M2+ D、MO2+12. 在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积压缩为原来的一半,当达到新的平衡时(A、B还是气体),B的浓度是原来的2.1倍,则( )A、平衡向正反应方向移动了 B、物质A的转化率减少了 C、物质B的质量分数减少了 D、a<b13. 下列说法正确的是( )A、煤的气化、液化和干馏是煤综合利用的主要方法,这些方法都与化学变化有关 B、苯是一种无色无味、不溶于水的液体 C、CH3COOCH2CH3与CH3CH2OOCCH3属于同分异构体 D、向鸡蛋白溶液中加入浓的Na2SO4溶液,蛋白质会析出,是因为蛋白质发生了变性14. 下列有关热化学方程式的叙述正确的是( )A、已知2H2(g)+O2(g)=2H2O(g);△H = -483.6kJ·mol-1,则氢气的燃烧热为241.8kJ B、已知4P(红磷,s)=P4(白磷,s); △H >0,则白磷比红磷稳定 C、含2.0g NaOH的稀溶液与稀硫酸完全中和,放出2.87kJ的热量,则表示该反应中和热的热化学方程式为: NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(1); △H = -57.4kJ·mol-1 D、已知C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2 则△H1>△H215. 在298K、100kPa时,1L水中可溶解0.09molCl2 , 实验测得溶于水的Cl2约有三分之一与水反应。下列说法正确的是( )A、氯气与水反应的离子反应方程式为:Cl2 + H2O 2H+ + Cl-+ ClO- B、为了增大氯水中HClO的浓度,可以向氯水中加入足量的NaOH固体,使氯气与水反应的平衡向右移动 C、向该条件下的氯水中加入盐酸,氯气与水反应的平衡移动方向与盐酸的浓度有关 D、向氯水中通入HCl气体,氯气与水反应的平衡向左移动,氯水的酸性减弱16. 下列关于电解的知识叙述中,错误的是( )
A、原子半径:Y>W B、Y原子通常得失电子都不容易,但在自然界中,Y元素不存在游离态 C、最低价氢化物的沸点:W<Z D、X的最高价氧化物的水化物既能与酸反应又能与碱反应9. 下列离子反应方程式正确的是( )A、AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B、NO2溶于水:3NO2+H2O=2H++2NO3-+NO C、Na2O2与水反应: 2O22-+2H2O=4OH-+O2↑ D、硝酸银溶液中放入铁粉:Ag+ + Fe = Fe2+ + Ag10. 下列各组离子在指定溶液中一定能大量共存的是( )A、1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- B、甲基橙呈红色的溶液:H+、Ba2+、AlO2-、Cl- C、pH=12的溶液:K+、Na+、CH3COO-、Br- D、与铝反应产生大量氢气的溶液:Na+、K+、NH4+、SO42-11. 将0.195克锌粉加入到20.0mL的0.100 mol·L-1 MO2+溶液中,恰好完全反应,则还原产物(只有一种)是( )A、M B、M+ C、M2+ D、MO2+12. 在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积压缩为原来的一半,当达到新的平衡时(A、B还是气体),B的浓度是原来的2.1倍,则( )A、平衡向正反应方向移动了 B、物质A的转化率减少了 C、物质B的质量分数减少了 D、a<b13. 下列说法正确的是( )A、煤的气化、液化和干馏是煤综合利用的主要方法,这些方法都与化学变化有关 B、苯是一种无色无味、不溶于水的液体 C、CH3COOCH2CH3与CH3CH2OOCCH3属于同分异构体 D、向鸡蛋白溶液中加入浓的Na2SO4溶液,蛋白质会析出,是因为蛋白质发生了变性14. 下列有关热化学方程式的叙述正确的是( )A、已知2H2(g)+O2(g)=2H2O(g);△H = -483.6kJ·mol-1,则氢气的燃烧热为241.8kJ B、已知4P(红磷,s)=P4(白磷,s); △H >0,则白磷比红磷稳定 C、含2.0g NaOH的稀溶液与稀硫酸完全中和,放出2.87kJ的热量,则表示该反应中和热的热化学方程式为: NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(1); △H = -57.4kJ·mol-1 D、已知C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2 则△H1>△H215. 在298K、100kPa时,1L水中可溶解0.09molCl2 , 实验测得溶于水的Cl2约有三分之一与水反应。下列说法正确的是( )A、氯气与水反应的离子反应方程式为:Cl2 + H2O 2H+ + Cl-+ ClO- B、为了增大氯水中HClO的浓度,可以向氯水中加入足量的NaOH固体,使氯气与水反应的平衡向右移动 C、向该条件下的氯水中加入盐酸,氯气与水反应的平衡移动方向与盐酸的浓度有关 D、向氯水中通入HCl气体,氯气与水反应的平衡向左移动,氯水的酸性减弱16. 下列关于电解的知识叙述中,错误的是( )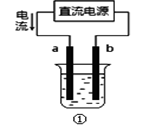
 A、用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液 B、工业上通过电解氯化钠溶液的方法制备金属钠 C、装置②的钢闸门应与外接电源的负极相连 D、向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极17. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )
A、用装置①精炼铜,则a极为粗铜,电解质溶液可为CuSO4溶液 B、工业上通过电解氯化钠溶液的方法制备金属钠 C、装置②的钢闸门应与外接电源的负极相连 D、向电子元件上镀上一层银,常需要电子元件做阴极,金属银作阳极17. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( ) A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀18. 下列说法错误的是( )A、用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因 B、工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率 C、在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大 D、汽车尾气中的NO和CO缓慢反应生成N2和CO2 , 为加快该化学反应的速率,最符合实际的措施是升高温度19. 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)
A、铁被氧化的电极反应式为Fe−3e−=Fe3+ B、铁腐蚀过程中化学能全部转化为电能 C、活性炭的存在会加速铁的腐蚀 D、以水代替NaCl溶液,铁不能发生吸氧腐蚀18. 下列说法错误的是( )A、用化学平衡移动原理的知识可以解释用排饱和食盐水收集Cl2的原因 B、工业上合成氨,平衡时将氨气液化分离,平衡向右移动,有利于提高H2的转化率 C、在硫酸工业中,三氧化硫的吸收阶段,吸收塔里要装填瓷环,以增大气液接触面积,使SO3的吸收速率增大 D、汽车尾气中的NO和CO缓慢反应生成N2和CO2 , 为加快该化学反应的速率,最符合实际的措施是升高温度19. 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1 , C的平均反应速率是0.1mol·L-1·min-1 , 且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是( ) A、x的值是2 B、开始时B的物质的量为3mol C、5min时,B的物质的量浓度为1.5 mol·L-1 D、5min时,容器中气体总的物质的量为7mol20. 在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和热。下列关于该实验的说法正确的是( )
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1 , C的平均反应速率是0.1mol·L-1·min-1 , 且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是( ) A、x的值是2 B、开始时B的物质的量为3mol C、5min时,B的物质的量浓度为1.5 mol·L-1 D、5min时,容器中气体总的物质的量为7mol20. 在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和热。下列关于该实验的说法正确的是( ) A、从实验装置看(量筒未画出),图中还缺少一个重要的仪器 B、做完一次完整的中和热测定实验,温度计需要使用2次 C、烧杯间的碎纸屑的作用是固定烧杯的位置 D、由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小
A、从实验装置看(量筒未画出),图中还缺少一个重要的仪器 B、做完一次完整的中和热测定实验,温度计需要使用2次 C、烧杯间的碎纸屑的作用是固定烧杯的位置 D、由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小二、推断题
-
21. A,B,C是中学化学常见物质(纯净物或水溶液),其转化关系如下(部分反应物或产物未标出;反应条件未标出)。回答下列问题:
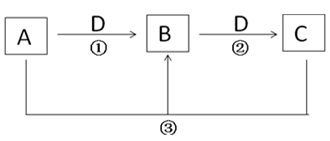 (1)、若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为.(2)、若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为(3)、若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为.(4)、若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2 . 则反应②的离子方程式为 .(5)、若D为O2 , 要实现上面的转化,A、C分别可以是(各填一种,填化学式) .22. 煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,1molF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。
(1)、若D为气体,在标况下的密度为1.964g·L-1;A为强碱溶液,其焰色反应为黄色,则反应②的化学方程式为.(2)、若B为白色胶状沉淀,D为强碱溶液.则反应③的离子方程式为(3)、若A为黄绿色的气体,D为目前使用量最大的金属单质,则检验B物质中的阳离子时发生的离子方程式为.(4)、若A为一种金属单质,常温下D浓溶液不能溶解A,D稀溶液能溶解A,但不产生H2 . 则反应②的离子方程式为 .(5)、若D为O2 , 要实现上面的转化,A、C分别可以是(各填一种,填化学式) .22. 煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,1molF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。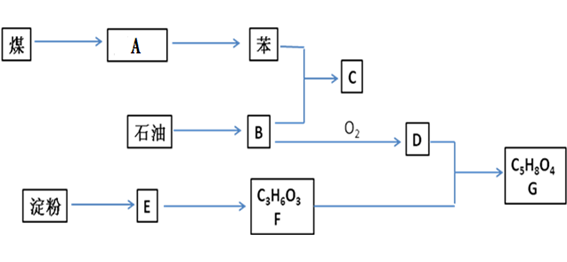
回答下列各题:
(1)、若A为煤焦油,则从A中分离出苯的方法是 , 工业上通过石油的制B物质.(2)、C为乙苯,则苯和B生成C的反应类型是 , C的结构简式是.(3)、写出B制备聚乙烯的反应方程式.(4)、写出D与F转化为G的反应方程式.三、综合题
-
23. 请运用化学反应原理的相关知识回答下列问题:(1)、焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为。该反应的△S 0(选填“>”、“<”或“=”),该反应在条件下能自发进行(选填“高温”、“低温”或“任意温度”)。(2)、CO是有毒的还原性气体,工业上有重要的应用。 CO是高炉炼铁的还原剂,其主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH = a kJ mol-1
①已知: Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1则a =。
②工业上高炉炼铁反应的平衡常数表达式K = , 温度升高后,K值(选填“增大”、“不变”或“减小”)。
③在T ℃时,该反应的平衡常数K = 64,在恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
Fe2O3
CO
Fe
CO2
甲/mol
1.0
1.0
1.0
1.0
乙/mol
1.0
2.0
1.0
1.0
下列说法正确的是(填字母)
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率为60%,大于乙
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.由于容器的体积未知,所以无法计算该条件下甲容器中CO的平衡转化率
(3)、请解释打开饮料“雪碧”的瓶盖,会有大量气泡冒出的原因:.(4)、甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。正极加入的物质是;负极的电极反应是。四、实验题
-
24. 盐酸与碳酸钙反应生成CO2 , 运用下图,可测定该反应的速率.请根据要求填空:
 (1)、连接好仪器后,需要检查 , 再加入药品进行实验.(2)、在锥形瓶中加入5g大理石,加入20mL 1mol·L−1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s−1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
(1)、连接好仪器后,需要检查 , 再加入药品进行实验.(2)、在锥形瓶中加入5g大理石,加入20mL 1mol·L−1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s−1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:时间/s
10
20
30
40
50
60
气体体积/mL
4
14
25
38
47
55
反应速率/mL·s−1
0.4
1.0
1.1
?
0.9
0.8
表格中的“?”处应填的数据是.
(3)、从反应速率随时间变化的数据可知,本实验中反应速率与和有关25. 实验室要配制240mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:(1)、若用Na2CO3固体配制溶液,下列仪器中,不需要用到的是______________。A、锥形瓶 B、200mL容量瓶 C、烧杯 D、胶头滴管 E、药匙 F、托盘天平 G、洗瓶 H、试剂瓶(2)、若要实施配制,除上述仪器外,尚缺的必须的仪器是。(3)、需要称量Na2CO3固体的质量是 。(4)、下列四项操作会导致所得溶液浓度偏高的是。a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
五、计算题
-
26. 向400mL某浓度的稀硝酸中加入Wg铁粉(还原产物只有NO),充分反应后,铁粉减少16.8 g且铁粉有剩余,继续向容器中加入足量的稀硫酸,会产生气体A。回答下列问题:(1)、稀硝酸的物质的量浓度是 mol·L−1(2)、气体A中若含有H2 , 则W的值一定要大于g.
-