专题20:原电池
试卷更新日期:2019-11-06 类型:一轮复习
一、单选题
-
1. 银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。下列说法错误的是( )
 A、Zn电极是负极 B、工作时K+移向Zn电极 C、Ag2O电极发生还原反应 D、Zn电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)22. 下列有关电池的叙述正确的是( )A、华为 Mate 系列手机采用的超大容量高密度电池是一种一次电池 B、原电池中的电极一定要由两种不同的金属组成 C、原电池中发生氧化反应的电极是负极 D、太阳能电池主要材料为二氧化硅3. 某小组为研究电化学原理,设计如图装置.下列叙述错误的是( )
A、Zn电极是负极 B、工作时K+移向Zn电极 C、Ag2O电极发生还原反应 D、Zn电极的电极反应式:Zn-2eˉ+2OHˉ=Zn(OH)22. 下列有关电池的叙述正确的是( )A、华为 Mate 系列手机采用的超大容量高密度电池是一种一次电池 B、原电池中的电极一定要由两种不同的金属组成 C、原电池中发生氧化反应的电极是负极 D、太阳能电池主要材料为二氧化硅3. 某小组为研究电化学原理,设计如图装置.下列叙述错误的是( ) A、a和b不连接时,铁片上会有金属铜析出 B、a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu C、无论a和b是否连接,铁片均会溶解 D、a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动4. 如图为发光二极管连接柠檬电池装置,下列说法正确的是( )
A、a和b不连接时,铁片上会有金属铜析出 B、a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu C、无论a和b是否连接,铁片均会溶解 D、a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动4. 如图为发光二极管连接柠檬电池装置,下列说法正确的是( ) A、铁环作为柠檬电池的正极 B、电子由发光二极管经导线流向Fe环 C、负极的电极反应为:Fe-2 e-=Fe2+ D、可将柠檬替换成盛装酒精溶液的装置5. 下图为番茄电池(已知番茄汁显酸性),下列说法正确的是( )
A、铁环作为柠檬电池的正极 B、电子由发光二极管经导线流向Fe环 C、负极的电极反应为:Fe-2 e-=Fe2+ D、可将柠檬替换成盛装酒精溶液的装置5. 下图为番茄电池(已知番茄汁显酸性),下列说法正确的是( ) A、锌电极是该电池的正极 B、铜电极附近会出现蓝色 C、一段时间后,锌片质量会变小 D、电子由铜通过导线流向锌6. 下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )A、
A、锌电极是该电池的正极 B、铜电极附近会出现蓝色 C、一段时间后,锌片质量会变小 D、电子由铜通过导线流向锌6. 下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是( )A、 B、
B、 C、
C、 D、
D、 7. 把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是:①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )A、②⑤ B、①③⑤ C、②④⑤ D、④⑤8. 与甲、乙两套装置有关的下列说法正确的是( )
7. 把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是:①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )A、②⑤ B、①③⑤ C、②④⑤ D、④⑤8. 与甲、乙两套装置有关的下列说法正确的是( )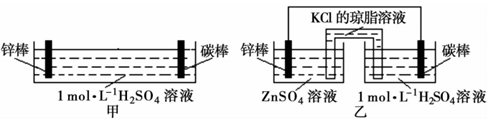 A、甲、乙装置中,锌棒均作负极,发生氧化反应 B、甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快 C、甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移 D、乙中盐桥设计的优点是迅速平衡电荷,提高电池效率9. 下列图示的装置不能形成原电池的是( )A、
A、甲、乙装置中,锌棒均作负极,发生氧化反应 B、甲中锌棒直接与稀H2SO4接触,故甲生成气泡的速率更快 C、甲、乙装置的电解质溶液中,阳离子均向碳棒定向迁移 D、乙中盐桥设计的优点是迅速平衡电荷,提高电池效率9. 下列图示的装置不能形成原电池的是( )A、 B、
B、 C、
C、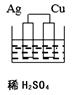 D、
D、 10. a、b、c、d、e五种金属,将a与b用导线接起来浸入电解质溶液中,a金属溶解;将a、d分别投入等浓度的盐酸中,d比a反应强烈;将铜浸入b的盐溶液里,无明显变化,把铜浸入c的盐溶液里,有c析出;将a与e用导线连接浸入电解质溶液中,电子沿导线流向a。则活动性顺序为( )A、a>c>e>d>b B、d>a>b>c>e C、d>b>a>c>e D、e>d>a>b>c11. 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
10. a、b、c、d、e五种金属,将a与b用导线接起来浸入电解质溶液中,a金属溶解;将a、d分别投入等浓度的盐酸中,d比a反应强烈;将铜浸入b的盐溶液里,无明显变化,把铜浸入c的盐溶液里,有c析出;将a与e用导线连接浸入电解质溶液中,电子沿导线流向a。则活动性顺序为( )A、a>c>e>d>b B、d>a>b>c>e C、d>b>a>c>e D、e>d>a>b>c11. 如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )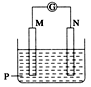
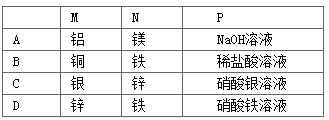 A、A B、B C、C D、D12. 新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+ Li++ e-=LiFePO4 , 负极:Li-e-=Li+。下列说法中正确的是( )A、充电时电池反应为FePO4+Li++e-=LiFePO4 B、放电时电池内部Li+向负极移动 C、充电时动力电池的阳极应与外接电源的正极相连 D、放电时,在正极上Li+得电子被还原13. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为: 。下列有关说法错误的是()
A、A B、B C、C D、D12. 新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+ Li++ e-=LiFePO4 , 负极:Li-e-=Li+。下列说法中正确的是( )A、充电时电池反应为FePO4+Li++e-=LiFePO4 B、放电时电池内部Li+向负极移动 C、充电时动力电池的阳极应与外接电源的正极相连 D、放电时,在正极上Li+得电子被还原13. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为: 。下列有关说法错误的是()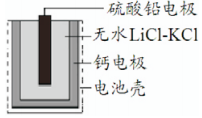 A、放电时,电子由Ca电极流出 B、放电时,Li+向PbSO4电极移动 C、负极反应式:
A、放电时,电子由Ca电极流出 B、放电时,Li+向PbSO4电极移动 C、负极反应式: D、每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
D、每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
二、填空题
-
14. 原电池是能将化学能转化为电能的装置。以锌-铜原电池为例图示如下:
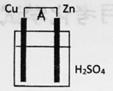
该电池Zn极是电池的(填“正极”或“负极“),电子从流出(填“Zn极”或“Cu极”),Cu极上的电极反应式是 。
15. FeCl3溶液可用作印刷电路铜板的腐蚀剂,该腐蚀过程的离子方程式为 . 若将该反应设计成原电池,请在如图方框中画出原电池的装置简图,标出正、负极及两极材料和电解质溶液.
三、综合题
-
16. 氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答下列问题:
 (1)、负极反应为。(2)、该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是 , 反应Ⅱ中的氧化剂是。17. 飞船上使用的氢氧燃料电池的两个电极均由多孔性碳制成。通入的气体由空隙中逸出,并在电极表面放电,总反应式为2H2+O2=2H2O。(1)、以KOH溶液为电解质构成燃料电池,则负极通入 , 电极反应式为 , 正极通入 , 电极反应式为。(2)、如把KOH溶液改为稀H2SO4作电解质,则电极反应式负极为 , 正极为。(3)、如把KOH溶液改为熔融氧化物(ZrO2和Y2O3)作电解质则电极反应式负极为 , 正极为。18.(1)、在下图的8个装置中,属于原电池的是。
(1)、负极反应为。(2)、该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiH,Ⅱ.LiH+H2O=LiOH+H2↑,反应Ⅰ中的还原剂是 , 反应Ⅱ中的氧化剂是。17. 飞船上使用的氢氧燃料电池的两个电极均由多孔性碳制成。通入的气体由空隙中逸出,并在电极表面放电,总反应式为2H2+O2=2H2O。(1)、以KOH溶液为电解质构成燃料电池,则负极通入 , 电极反应式为 , 正极通入 , 电极反应式为。(2)、如把KOH溶液改为稀H2SO4作电解质,则电极反应式负极为 , 正极为。(3)、如把KOH溶液改为熔融氧化物(ZrO2和Y2O3)作电解质则电极反应式负极为 , 正极为。18.(1)、在下图的8个装置中,属于原电池的是。 (2)、依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
(2)、依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
①电极X的材料是;电解质溶液Y是;
②银电极为电池的极,发生的电极反应为;
(3)、航天飞机常采用燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能。如图是甲烷燃料电池原理示意图,回答下列问题: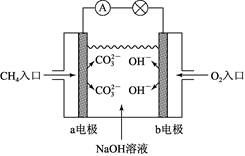
①电池的负极是(填“a”或“b”),该极的电极反应是。
②消耗标准状况下5.6 L O2时,有mol电子发生转移。
③开始放电时,正极附近溶液的pH(填“增大”“减小”或“不变”)
④以铜为电极,用此电池作电源,电解以下溶液,开始阶段发生反应Cu+2H2O=Cu(OH)2+H2↑的有。
A.稀H2SO4 B.NaOH溶液 C.Na2SO4溶液
D.CuSO4溶液 E.NaCl溶液
19. 银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。将变黑的银质器皿放入下图装置,一段时间后发现黑色会褪去。回答下列问题: (1)、铝为极,KNO3盐桥中的离子进入a烧杯中,银器的电极反应式为。(2)、如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,阳极的电极反应式是 , 总反应的化学方程式是。20. 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)、铝为极,KNO3盐桥中的离子进入a烧杯中,银器的电极反应式为。(2)、如不用盐桥,将铝片和银器插入一个盛食盐水的烧杯中处理,阳极的电极反应式是 , 总反应的化学方程式是。20. 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: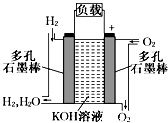 (1)、氢气进入的这级为极;(2)、写出氢氧燃料电池工作时电极反应方程式:;(3)、该氢氧燃料电池每转移0.1mol电子,消耗标准状态下 L氧气;(4)、若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
(1)、氢气进入的这级为极;(2)、写出氢氧燃料电池工作时电极反应方程式:;(3)、该氢氧燃料电池每转移0.1mol电子,消耗标准状态下 L氧气;(4)、若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .