黑龙江省龙东南七校2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-11-04 类型:期末考试
一、单选题
-
1. 下列说法正确的是( )A、活化分子间的碰撞一定是有效碰撞 B、吸热反应只有加热才能发生 C、有能量变化的一定是化学反应 D、化学键断裂要吸收能量2. 用2g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
①再加入30mL3mol/L盐酸②改用30mL6mol/L盐酸③改用2g粉末状大理石④适当升高温度.
A、①②④ B、②③④ C、①③④ D、①②③3. 将①H+、②Cl﹣、③Al3+、④K+、⑤S2﹣、⑥OH﹣、⑦NO3﹣、⑧NH4+ 分别加入H2O中,基本上不影响水的电离平衡的是( )A、①③⑤⑦⑧ B、②④⑦ C、①⑥ D、②④⑥⑧4. 在恒容密闭容器中,进行如下反应:NO(g)+CO(g) N2(g)+CO2(g);△H=﹣373.2kJ/mol达到平衡后,为提高NO的转化率,采取的正确措施是( )A、加催化剂 B、充入CO增大压强 C、充入N2 D、升高温度5. 室温下,向0.1mol/L醋酸中通入氯化氢气体,下列描述错误的是( )A、pH逐渐减小 B、c(H+)增大 C、水的电离程度会不断增大 D、Kw不变6. 下列关于铜电极的叙述中,正确的是( )A、铜锌原电池中铜是正极 B、用电解法精炼粗铜时粗铜作阴极 C、在镀件上电镀铜时可用镀件作阳极 D、电解稀硫酸制H2、O2时铜作阳极7. 将下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥氯化铜
A、③④ B、①③④ C、①②③④⑤ D、全部8. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )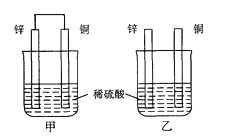 A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢9. 用惰性电极电解下列各组物质的水溶液时,发生的电极反应完全相同的是( )A、NaOH、H2SO4 B、CuCl2、Cu(NO3)2 C、Na2SO4、NaCl D、KNO3、AgNO310. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g11. 物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3按c(CO32-)由小到大顺序排列正确的是( )A、④<③<②<① B、③<②<④<① C、③<②<①<④ D、③<④<②<①12. 在由水电离的c(H+)=10-14mol·L-1的溶液中,一定能大量共存的离子组是( )A、K+、Fe2+、S2-、MnO4- B、Al3+、Cl-、NH4+、SO42- C、Na+、NO3-、Cl-、SO42- D、Na+、AlO2-、Br-、Cl-13. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述错误的是( )
A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均增大 D、产生气泡的速度甲比乙慢9. 用惰性电极电解下列各组物质的水溶液时,发生的电极反应完全相同的是( )A、NaOH、H2SO4 B、CuCl2、Cu(NO3)2 C、Na2SO4、NaCl D、KNO3、AgNO310. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) C、电池工作时,电子由正极通过外电路流向负极 D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g11. 物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3按c(CO32-)由小到大顺序排列正确的是( )A、④<③<②<① B、③<②<④<① C、③<②<①<④ D、③<④<②<①12. 在由水电离的c(H+)=10-14mol·L-1的溶液中,一定能大量共存的离子组是( )A、K+、Fe2+、S2-、MnO4- B、Al3+、Cl-、NH4+、SO42- C、Na+、NO3-、Cl-、SO42- D、Na+、AlO2-、Br-、Cl-13. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述错误的是( ) A、a电极是负极 B、b电极的电极反应式为:4OH--4e-=2H2O +O2↑ C、氢氧燃料电池是一种具有应用前景的绿色电源 D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置14. 下列过程通电后才能进行的是( )
A、a电极是负极 B、b电极的电极反应式为:4OH--4e-=2H2O +O2↑ C、氢氧燃料电池是一种具有应用前景的绿色电源 D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置14. 下列过程通电后才能进行的是( )①电离;②电解;③电镀;④电化学腐蚀
A、①②③ B、①②④ C、②③ D、全部15. 有① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1 , 下列说法正确的是( )A、3种溶液pH的大小顺序是③>②>① B、若将3种溶液稀释相同倍数,pH变化最大的是② C、若分别加入25mL0.1mol·L-1盐酸后,pH最大的是① D、若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②16. 下列溶液中浓度关系正确的是( )A、小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B、CH3COONa溶液中:c(CH3COO-)>c(Na+) C、物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) D、0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)17. 下列实验和结论均正确的是( )实验
结论
A
中和热的测定实验中,若将环形玻璃搅拌棒换成铜棒
测得ΔH偏小
B
中和滴定实验中,锥形瓶用待测液润洗
测量结果将偏低
C
向氯化铁溶液中滴入KSCN溶液出现红色沉淀
Fe3+与SCN-反应生成红色物质
D
25℃,分别向等体积,浓度分别为0.1 mol/L和0.5 mol/L的草酸溶液中滴入少量等量的酸性高锰酸钾,后者褪色快。
其它条件相同,草酸的浓度越大,反应速率越快
A、A B、B C、C D、D18. 下列依据热化学方程式得出的结论正确的是( )A、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol B、已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2 , 则2ΔH1<ΔH2 C、已知2SO2(g)+O2(g) 2SO3(g) ΔH=-QkJ/mol(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量 D、已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定19. 用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,正确的一组是( )X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
Cu(NO3)2
Cu(NO3)2溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
A、A B、B C、C D、D20. 醋酸溶液中存在电离平衡CH3COOH H++CH3COO- , 错误的是( )A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) B、常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 D、常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<721. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )A、 升高温度,平衡常数减小
B、
升高温度,平衡常数减小
B、 0-3s内,反应速率v(NO2)=0.2mol•L-1
C、
0-3s内,反应速率v(NO2)=0.2mol•L-1
C、 t1时仅加入催化剂,平衡正向移动
D、
t1时仅加入催化剂,平衡正向移动
D、 达到平衡时,仅改变X,则X为c(O2)
22. 在室温下有0.1 mol·L-1的下列物质:①Na2CO3溶液;②NH4HCO3溶液;③NaHCO3溶液;④NaHSO3溶液;⑤NaHSO4溶液;⑥NaHS溶液。其中,既能跟NaOH溶液反应,又能跟盐酸反应,且pH>7的是( )A、①③④ B、②④⑥ C、②③⑥ D、①③⑤23. 在20mL0.1mol·L-HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是( )A、C(H+)+C(NH4+)=C(OH-)+C(Cl-) B、C(H+)= C(OH-)+ C(NH 3·H2O) C、C(Cl-)>C(NH4+)>C(OH-)>C(H+) D、C(Cl-)=C(NH4+)+ C(NH 3·H2O)24. 1000mL硝酸钾和硝酸铜的混合溶液中c(NO3-)=3.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况)。下列说法正确的是( )A、原混合溶液中钾离子浓度为2mol/L B、上述电解过程中共转移6mol电子 C、电解得到的铜的物质的量为0.5mol D、电解后溶液中氢离子浓度为2mol/L25. 下列生产或实验事实引出的相应结论错误的是( )
达到平衡时,仅改变X,则X为c(O2)
22. 在室温下有0.1 mol·L-1的下列物质:①Na2CO3溶液;②NH4HCO3溶液;③NaHCO3溶液;④NaHSO3溶液;⑤NaHSO4溶液;⑥NaHS溶液。其中,既能跟NaOH溶液反应,又能跟盐酸反应,且pH>7的是( )A、①③④ B、②④⑥ C、②③⑥ D、①③⑤23. 在20mL0.1mol·L-HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是( )A、C(H+)+C(NH4+)=C(OH-)+C(Cl-) B、C(H+)= C(OH-)+ C(NH 3·H2O) C、C(Cl-)>C(NH4+)>C(OH-)>C(H+) D、C(Cl-)=C(NH4+)+ C(NH 3·H2O)24. 1000mL硝酸钾和硝酸铜的混合溶液中c(NO3-)=3.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况)。下列说法正确的是( )A、原混合溶液中钾离子浓度为2mol/L B、上述电解过程中共转移6mol电子 C、电解得到的铜的物质的量为0.5mol D、电解后溶液中氢离子浓度为2mol/L25. 下列生产或实验事实引出的相应结论错误的是( )选项
事实
结论
A
工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧
增大反应物的接触面积,加快化学反应速率
B
A、B两支试管中分别加入等体积5%的H2O2 , 在B试管中加入MnO2 , B试管中产生气泡快
当其他条件不变时,催化剂可以改变化学反应速率
C
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短
当其他条件不变时,升高反应温度,化学反应速率加快
D
一定条件下:H2(g)+I2(g) 2HI(g)达到反应平衡,缩小体积颜色加深
c(I2)增大,I2物质的量增多
A、A B、B C、C D、D26. 浓度均为0.10 mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积为V,pH随lg 的变化如图所示。下列叙述错误的是( )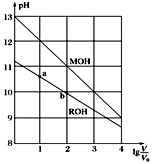 A、当lg =2时,若两溶液同时升高温度,则 增大 B、MOH的碱性强于ROH的碱性 C、ROH的电离程度:b点大于a点 D、若两溶液无限稀释,则它们的c(OH-)相等27. 在相同的条件下测得①NaCN ②CH3COONa ③NaClO三种溶液pH相同,并且Ka(CH3COOH)>Ka(HClO)>Ka(HCN),则它们的物质的量浓度的大小顺序是( )A、①>②>③ B、②>①>③ C、②>③>① D、③>①>②28. 室温下在一定体积某浓度的Ba(NO3)2溶液中逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测定溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积之比是( )A、1:10 B、1:9 C、10:1 D、9:129. 可逆反应:3A(气) 3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )A、B和C可能都是固体 B、B和C一定都是气体 C、若C为气体,则B一定是固体 D、B和C可能都是气体30. 下列有关金属腐蚀的说法中正确的是( )A、钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法 B、电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 C、钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈 D、金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
A、当lg =2时,若两溶液同时升高温度,则 增大 B、MOH的碱性强于ROH的碱性 C、ROH的电离程度:b点大于a点 D、若两溶液无限稀释,则它们的c(OH-)相等27. 在相同的条件下测得①NaCN ②CH3COONa ③NaClO三种溶液pH相同,并且Ka(CH3COOH)>Ka(HClO)>Ka(HCN),则它们的物质的量浓度的大小顺序是( )A、①>②>③ B、②>①>③ C、②>③>① D、③>①>②28. 室温下在一定体积某浓度的Ba(NO3)2溶液中逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测定溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积之比是( )A、1:10 B、1:9 C、10:1 D、9:129. 可逆反应:3A(气) 3B(?)+C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是 ( )A、B和C可能都是固体 B、B和C一定都是气体 C、若C为气体,则B一定是固体 D、B和C可能都是气体30. 下列有关金属腐蚀的说法中正确的是( )A、钢铁闸门接在电源的负极上,此方法称为牺牲阳极的阴极保护法 B、电化学腐蚀指在外加电流的作用下不纯金属发生化学反应而损耗的过程 C、钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈 D、金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生二、填空题
-
31. 如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。
 (1)、A,B,C三个装置中属于原电池的是(填标号,下同),属于电解池的是。(2)、A池中Zn是极,电极反应式为;Cu是极,电极反应式为 , A中总反应的方程式。(3)、B池中总反应的方程式为。(4)、C池中Zn是极,电极反应式为;Cu是 极,电极反应式为。
(1)、A,B,C三个装置中属于原电池的是(填标号,下同),属于电解池的是。(2)、A池中Zn是极,电极反应式为;Cu是极,电极反应式为 , A中总反应的方程式。(3)、B池中总反应的方程式为。(4)、C池中Zn是极,电极反应式为;Cu是 极,电极反应式为。三、综合题
-
32.(1)、Ⅰ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
正确操作步骤的顺序是(用字母填写)→→→ D→。
(2)、D步骤中液面应调节到 , 尖嘴部分应。(3)、滴定终点时锥形瓶中颜色变化是。(4)、若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(填“偏高”、“低”或“不变”)(5)、该烧碱样品纯度的计算式为。(6)、Ⅱ. 常温下,0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。②求出混合溶液中下列算式的精确计算结果(填具体数字)。
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
(7)、常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH(填“>7”或“<7”或“无法确定”)。33. 某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:实验编号
实验温度
试管中所加试剂及其用量 / mL
溶液褪至无色所需时间/ min
0.6mol/L H2C2O4
溶液
H2O
3mol/L H2SO4
稀溶液
0.05mol/L
KMnO4溶液
①
25
3.0
V1
2.0
3.0
1.5
②
25
2.0
3.0
2.0
3.0
2.7
③
50
2.0
V2
2.0
3.0
1.0
(1)、请写出该反应的离子方程式 , 当该反应以表中数据反应完全时转移电子数为NA;(2)、V1= mL;(3)、根据上表中的实验①、②数据,可以得到的结论是。(4)、探究温度对化学反应速率的影响,应选择(填实验编号);(5)、该小组同学根据经验绘制了n(Mn 2+)随时间变化的趋势如图所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn 2+)随时间变化的实际趋势如图所示。
该小组同学根据如图所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号
实验温度/℃
试管中所加试剂及其用量
再加入某种固体
溶液褪至无色所需时间 / min
④
25
0.6mol/L H2C2O4
H2O
3mol/L H2SO4
0.05mol/L KMnO4溶液
2.0
3.0
2.0
3.0
MnSO4
t
①小组同学提出的假设是。
②若该小组同学提出的假设成立,应观察到现象。
-