专题19:化学反应速率与化学平衡
试卷更新日期:2019-11-01 类型:一轮复习
一、单选题
-
1. 中华传统文化蕴含着很多科学知识,下列说法错误的是( )A、“丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应 B、“水声冰下咽,沙路雪中平”未涉及化学变化 C、“霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应 D、“含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴2. 能说明在固定的密闭容器中进行的反应:3H2(g)+N2(g)⇌ 2NH3(g) 已经达到平衡的是:( )A、c(H2):c(N2):c(NH3)=3:1:2 B、容器内气体的密度不再改变 C、容器内气体的平均摩尔质量不变 D、氢气消耗的速率是氮气消耗速率的3倍3. 在2 L的密闭容器中,发生以下反应:2A(g)+B(g) 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )A、3.4 mol B、3.2 mol C、2.8 mol D、1.2 mol4. 以下是反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是( )A、υ(A)=0.45mol·L-1·s-1 B、υ(B)=0.6mol·L-1·s-1 C、υ(C)=0.4mol·L-1·s-1 D、υ(D)=0.45mol·L-1·s-15. 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A、①② B、①④ C、②③ D、③④6. 符合如图的反应是( ) A、X+3Y 2Z ΔH>0 B、X+3Y 2Z ΔH<0 C、X+2Y 3Z ΔH<0 D、5X+3Y 4Z ΔH<07. 在密闭容器中发生反应m A(g)+n B(g ) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A、X+3Y 2Z ΔH>0 B、X+3Y 2Z ΔH<0 C、X+2Y 3Z ΔH<0 D、5X+3Y 4Z ΔH<07. 在密闭容器中发生反应m A(g)+n B(g ) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
A、m+n>p B、平衡向逆反应方向移动 C、A的转化率提高 D、C的体积分数增加8. 在1L的密闭容器中,发生反应4A(s)+3B(g) 2C(g)+D(g),经2min后B的浓度减少0.6mol/L.对此反应速率的正确表示是( )A、用A表示的反应速率是0.4mol/(L·min) B、用B、C、D分别表示的反应速率,其比值是3:2:1 C、在第2min末的反应速率用B表示是0.3 mol/(L·min) D、在这2min内用B表示的速率的值逐渐减小,用C表示的速率的值逐渐增大9. 已知某可逆反应m A(g)+n B(g) p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( ) A、T1<T2 p1>p2 m+n>p 放热反应 B、T1>T2 p1<p2 m+n>p 吸热反应 C、T1<T2 p1>p2 m+n<p 放热反应 D、T1>T2 p1<p2 m+n<p 吸热反应10. 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)
A、T1<T2 p1>p2 m+n>p 放热反应 B、T1>T2 p1<p2 m+n>p 吸热反应 C、T1<T2 p1>p2 m+n<p 放热反应 D、T1>T2 p1<p2 m+n<p 吸热反应10. 一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g) 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( ) ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度.
A、①②④ B、②③ C、②③④ D、全部11. 反应 C(s)+ H2O (g) CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( ) A、CO的体积分数最高的一段时间为t5-t6 B、t2-t3和t3-t4时间段H2的体积分数相等 C、t1时刻改变的条件是降低温度 D、t4-t5时间段平衡向正反应方向移动12. 下图是关于反应A2(g)+B2(g) 2C(g)+D(g) ΔH<0的平衡移动图像,影响平衡移动的原因可能是( )
A、CO的体积分数最高的一段时间为t5-t6 B、t2-t3和t3-t4时间段H2的体积分数相等 C、t1时刻改变的条件是降低温度 D、t4-t5时间段平衡向正反应方向移动12. 下图是关于反应A2(g)+B2(g) 2C(g)+D(g) ΔH<0的平衡移动图像,影响平衡移动的原因可能是( ) A、升高温度,同时加压 B、压强不变,降低温度 C、压强、温度不变,充入一些与之不反应的惰性气体 D、温度 、压强不变,充入一些A2(g)13. 在化学反应A(g)+3B(g) 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )A、v(A)=v(B) B、v(A)=2v(C) C、3v(B)=v(C) D、v(B)=3v(D)14. 如图所示,向A和B中都充人2molX和2molY,起始V(A)=0.8a L,V(B)=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)
A、升高温度,同时加压 B、压强不变,降低温度 C、压强、温度不变,充入一些与之不反应的惰性气体 D、温度 、压强不变,充入一些A2(g)13. 在化学反应A(g)+3B(g) 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )A、v(A)=v(B) B、v(A)=2v(C) C、3v(B)=v(C) D、v(B)=3v(D)14. 如图所示,向A和B中都充人2molX和2molY,起始V(A)=0.8a L,V(B)=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2Z(g)+W(g)达到平衡时,V(A)=0.9a L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,V(A)=0.9a L,则下列说法错误的是 ( )  A、两容器中达到平衡的时间A<B B、打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大 C、A容器中X的转化率为25%,且比B容器中的X的转化率小 D、打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)15. 已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )A、△H增大 B、平衡常数K增大 C、v(X):v(Y)=m:n D、混合气体的平均相对分子质量变大16. 可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
A、两容器中达到平衡的时间A<B B、打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大 C、A容器中X的转化率为25%,且比B容器中的X的转化率小 D、打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)15. 已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q。在恒容密闭容器中反应达到平衡时,若升高体系温度,下列说法正确的是( )A、△H增大 B、平衡常数K增大 C、v(X):v(Y)=m:n D、混合气体的平均相对分子质量变大16. 可逆反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( ) A、达平衡后,若升温,平衡右移 B、达平衡后,加入催化剂则C%增大 C、化学方程式中n>e+f D、达平衡后,增加A的量有利于平衡向右移动17. 反应mX(g)+nY(g) pZ(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是( )
A、达平衡后,若升温,平衡右移 B、达平衡后,加入催化剂则C%增大 C、化学方程式中n>e+f D、达平衡后,增加A的量有利于平衡向右移动17. 反应mX(g)+nY(g) pZ(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是( ) A、T1<T2 , P1<P2 B、T1<T2 , P1>P2 C、T1>T2 , P1>P2 D、T1>T2 , P1<P2
A、T1<T2 , P1<P2 B、T1<T2 , P1>P2 C、T1>T2 , P1>P2 D、T1>T2 , P1<P2二、填空题
-
18. 已知一定条件下合成氨反应:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
2NH3(g) ΔH=-92.4 kJ·mol-1 , 在反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
t1; t2; t3; t4。
19. 现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)、该反应的逆反应为反应(填“吸热”或“放热”),且m+np(填“>”“=”或“<”)。(2)、减压使容器体积增大时,A的质量分数。(填“增大” “减小”或“不变”,下同)(3)、若加入B(维持体积不变),则A的转化率。(4)、若升高温度,则平衡时B、C的浓度之比将。(5)、若加入催化剂,平衡时气体混合物的总物质的量。三、实验探究题
-
20. CO2的资源化利用能有效减少CO2排放,充分利用碳资源。(1)、CaO可在较高温度下捕集CO2 , 在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。

①写出400~600 ℃范围内分解反应的化学方程式:。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是。
(2)、电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
①写出阴极CO2还原为HCOO−的电极反应式:。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是。
(3)、CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH =41.2 kJ·mol−1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性= ×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有。
四、综合题
-
21. 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。(1)、短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是: ;(2)、为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为;(3)、氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) 2NH3(g)。
①合成氨的反应中的能量变化如右图所示。该反应是反应(填“吸热”或“放热”),

②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g) ⇌2NH3(g) , 5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)= ;氢气达到平衡时的转化率是: (保留小数点后一位);
(4)、美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:;若将上述装置中的氢气换成甲醇,其余都不改变,对应装置的负极反应方程式为;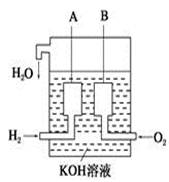 22. 二氧化氮是重要的氧化剂,存在如下平衡: 2NO2(g)
22. 二氧化氮是重要的氧化剂,存在如下平衡: 2NO2(g) N2O4(g)
(1)、已知:2NO2(g)
N2O4(g)
(1)、已知:2NO2(g) N2O4(g)△H=﹣57.20kJ·mol﹣1 . 一定条件下,在体积一定的密闭容器中反应2NO2(g)
N2O4(g)△H=﹣57.20kJ·mol﹣1 . 一定条件下,在体积一定的密闭容器中反应2NO2(g)  N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是 (填字母). A、减小NO2的浓度 B、降低温度 C、增加NO2的浓度 D、升高温度(2)、17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是 (填字母). A、减小NO2的浓度 B、降低温度 C、增加NO2的浓度 D、升高温度(2)、17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L﹣1、c(N2O4)=0.0120mol·L﹣1 . 反应2NO2(g)
 N2O4(g)的平衡常数K= . 23. 在容器体积可变的密闭容器中,反应N2(g) 3H2(g) 2NH3(g)在一定条件下达到平衡。
N2O4(g)的平衡常数K= . 23. 在容器体积可变的密闭容器中,反应N2(g) 3H2(g) 2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)、若该反应经过2秒钟后达到平衡,NH3的浓度增加了0.4mol/L,在此期间,正反应速率 (H2)的值为()A 0.6mol/(L·s) B 0.45 mol/(L·s) C 0.3 mol/(L·s) D 0.2 mol/(L·s)
(2)、在其他条件不变的情况下,增大容器体积以减小反应体系的压强, (选填“增大”、“减小”,下同), , 平衡向方向移动(选填“正反应”、“逆反应”)。 (3)、在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为反应(选填“吸热”、“放热”)。(4)、如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是(填写编号)。
(3)、在其他条件不变的情况下,升高温度平衡向逆反应方向移动,则正反应为反应(选填“吸热”、“放热”)。(4)、如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是(填写编号)。a.增大H2的浓度
b.缩小容器体积
c.加入催化剂
d.升高温度
改变条件后,平衡混合物中NH3的百分含量(选填“增大”、“减小”、“不变”)。在一定条件下,反应2A+B C达到平衡。
(5)、若升高温度,平衡向正反应方向移动,则逆反应是热反应;(6)、若增加或减少B时,平衡不移动,则B是态;(7)、若A、B、C均为气态,将6mol A、3mol B充入容积为0.5L的密闭容器中,进行反应。经5s后,测得容器内有1mol B,则用A表示的反应速率为 , 5s末时C的物质的量浓度为。
-