专题18:化学反应与能量变化
试卷更新日期:2019-11-01 类型:一轮复习
一、单选题
-
1. 下列选项描述的过程能实现化学能转化为电能的是( )




A.蜡烛燃烧
B.光合作用
C.手机电池工作
D.太阳能板充电
A、A B、B C、C D、D2. 节能减排是我国政府工作地重点之一,节约能源与开发新能源是当务之急。下列方案中,你认为不合理的是( )A、提升电解水法提供氢能的技术 B、开发将生物质转变成热值较高的可燃气体的技术 C、研制以甲醇为燃料的汽车 D、开发太阳能路灯代替传统路灯3. 古语道:“人要实,火要虚”。此话的意思是做人必须脚踏实地,事业才能有成;燃烧固体燃料需要架空,燃烧才能更旺。从燃烧的条件看,“火要虚”的实质是( )A、增大可燃物的热值 B、提高空气中氧气的含量 C、提高可燃物的着火点 D、增大可燃物与空气的接触面积4. 某反应使用催化剂后,其反应过程中能量变化如图,下列说法错误的是( ) A、总反应为放热反应 B、使用催化剂后,活化能不变 C、反应①是吸热反应,反应②是放热反应 D、ΔH=ΔH1+ΔH25. 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列表示甲醇燃烧热的热化学方程式正确的是( )A、CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ·mol﹣1 B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1452 kJ·mol﹣1 C、CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=﹣725.8 kJ·mol﹣1 D、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1 452 kJ·mol﹣16. 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O( l )△H=-57.3kJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )A、△H1>△H2>△H3 B、△H1<△H2<△H3 C、△H1>△H2=△H3 D、△H1=△H2<△H37. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( )
A、总反应为放热反应 B、使用催化剂后,活化能不变 C、反应①是吸热反应,反应②是放热反应 D、ΔH=ΔH1+ΔH25. 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列表示甲醇燃烧热的热化学方程式正确的是( )A、CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ·mol﹣1 B、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1452 kJ·mol﹣1 C、CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=﹣725.8 kJ·mol﹣1 D、2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1 452 kJ·mol﹣16. 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O( l )△H=-57.3kJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )A、△H1>△H2>△H3 B、△H1<△H2<△H3 C、△H1>△H2=△H3 D、△H1=△H2<△H37. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的是( ) A、△H2>0;△H5<0 B、△H2+△H3+△H4<△H1 C、在相同条件下,2K(g)→2K+(g)的△H3’<△H3 D、NaCl(g) →NaCl(s)的过程中有离子键形成8. 在1200℃时,天然气脱硫工艺中会发生下列反应
A、△H2>0;△H5<0 B、△H2+△H3+△H4<△H1 C、在相同条件下,2K(g)→2K+(g)的△H3’<△H3 D、NaCl(g) →NaCl(s)的过程中有离子键形成8. 在1200℃时,天然气脱硫工艺中会发生下列反应①H2S(g)+ O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A、△H4=2/3(△H1+△H2-3△H3) B、△H4=2/3(3△H3-△H1-△H2) C、△H4=3/2(△H1+△H2-3△H3) D、△H4=3/2(△H1-△H2-3△H3)9. 下列反应一定属于放热反应的是( )A、氢氧化钡晶体和氯化铵晶体的反应 B、反应物能量比生成物能量低的反应 C、化学键断裂吸收的能量比化学键形成放出的能量少的反应 D、不需要加热就能发生的反应10. 氢气是未来的绿色能源,科学家们最新研制出利用太阳能产生激光,再用激光使水分解得到氢气的新技术:激光2H2O 2H2↑+O2↑。下列有关说法错误的是( )A、水分解不产生污染物 B、该反应中水分解会释放能量 C、TiO2在反应中作催化剂 D、该技术将太阳能转化为化学能11. 已知热化学方程式:SO2(g)+ 1/2O2(g) SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )A、196.64kJ B、小于98.32kJ C、小于196.64kJ D、大于196.64kJ12. 已知下列热化学方程式:C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 现有0.2 mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53 kJ热量,则炭粉与氢气的物质的量之比为( )A、1∶1 B、1∶2 C、2∶3 D、3∶213. 下列图示变化为吸热反应的是( )A、 B、
B、 C、
C、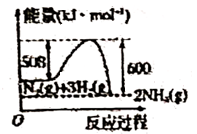 D、
D、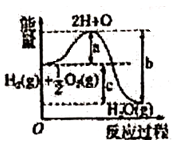 14. 1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是( )A、C(s)+O2(g)→CO2(g)+393kJ B、C + O2→ CO2+393kJ C、C (s) + O2 (g)→CO2 (g)-393kJ D、C (s) +1/2O2 (g) → CO(g) +393kJ
14. 1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是( )A、C(s)+O2(g)→CO2(g)+393kJ B、C + O2→ CO2+393kJ C、C (s) + O2 (g)→CO2 (g)-393kJ D、C (s) +1/2O2 (g) → CO(g) +393kJ二、填空题
-
15. CH4的燃烧热为893 kJ·mol-1 , 写出表示甲烷燃烧热的热化学方程式:。16. 科学家Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的△H便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=a kJ•mol﹣1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=b kJ•mol﹣1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=c kJ•mol﹣1
请写出CO还原FeO的热化学方程式: .
三、综合题
-
17. 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
 (1)、从实验装置上看,图中尚缺少的一种玻璃仪器是 .(2)、大烧杯上如果不盖硬纸板,求得的中和热数值(填“偏 大”,“偏小”或“无影响”).(3)、实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”),简述理由: .(4)、若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为: ①3.2℃ ②2.2℃ ③3.0℃写出表示盐酸与NaOH溶液反应的中和热的热化学方程式 .
(1)、从实验装置上看,图中尚缺少的一种玻璃仪器是 .(2)、大烧杯上如果不盖硬纸板,求得的中和热数值(填“偏 大”,“偏小”或“无影响”).(3)、实验中改用60mL 0.50mol/L盐酸跟50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热(填“相等”“不相等”),简述理由: .(4)、若两溶液的密度都是1g/mL,中和后所得溶液的比热容c=4.18J/(g·℃),三次平行操作测得终止温度与起始温度差(t2﹣t1)分别为: ①3.2℃ ②2.2℃ ③3.0℃写出表示盐酸与NaOH溶液反应的中和热的热化学方程式 .(小数点后保留一位小数)
18. 已知下列热化学方程式:① H2(g)+ O2(g)=H2O(l) ΔH =-285kJ/mol
② H2(g)+ O2(g)=H2O(g) ΔH =-241.8kJ/mol
③ C(s)+ O2(g)=CO(g) ΔH =-110.4 kJ/mol
④ C(s)+ O2(g)=CO2(g) ΔH =-393.5 kJ/mol
回答下列各问:
(1)、上述反应中属于放热反应的是。(2)、C的燃烧热为。(3)、燃烧10g H2生成液态水,放出的热量为。(4)、CO燃烧的热化学方程式为。(5)、为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施。a 减压、升温 b 增压、降温
c 减压、降温 d 增压、升温