专题17:水溶液中的离子平衡
试卷更新日期:2019-11-01 类型:一轮复习
一、单选题
-
1. 现有Na2CO3、Ba(OH)2、H2SO4三种体积和物质的量浓度都相同的溶液,以不同的顺序将它们混合,如生成沉淀,立即过滤掉,对于所得溶液的酸碱性,如下结论错误的是( )A、一定显碱性 B、可能显中性 C、不可能显酸性 D、可能显碱性2. 某无色透明的溶液,在c(H+)水= 1x10-13的条件下都能大量共存的是( )A、Fe2+ K+ SO42- NO3- B、Mg2+ NH4+ SO42- Cl- C、Ba2+ Na+ MnO4- SO42- D、Na+ K+ SO42- NO3-3. 已知某温度下,K(HCN)=6.2×10-10、K(HF)=6.8×10-4、K(CH3COOH)=1.8×10-5、K(HNO2)=6.4×10-6。物质的量浓度都为0.1 mol/L的下列溶液中,c(H+)浓度由大到小的次序是( )A、HCN>HNO2>CH3COOH>HF B、HF>CH3COOH>HNO2>HCN C、HCN>CH3COOH>HF>HNO2 D、CH3COOH>HCN>HF>HNO24. 醋酸的下列性质中,可以证明它是弱电解质的是( )
①1 mol/L的醋酸溶液中c(H+)=0.01 mol/L
②醋酸以任意比与水互溶
③10 mL 1mol/L的醋酸溶液恰好与10 mL 1 mol/L的NaOH溶液完全反应
④在相同条件下,醋酸溶液的导电性比盐酸弱
A、④ B、①③④ C、①④ D、②④5. 室温下,在pH=12的某碱溶液中,由水电离产生的c(OH-)为( )A、1.0×10-7mol·L-1 B、1.0×10-2mol·L-1 C、1.0×10-6mol·L-1 D、1.0×10-12mol·L-16. 25℃,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是( )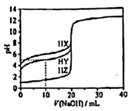 A、HZ为强酸,HY、HX均为弱酸,且相同条件下Ka(HX)<Ka(HY) B、加入10.00 mLNaOH溶液时,三种溶液中水的电离程度大小为:HX<HY<HZ C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) D、HY溶液中加入20.00 mLNaOH溶液,溶液中存在:c(OH-)=c(HY)+c(H+)7. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
A、HZ为强酸,HY、HX均为弱酸,且相同条件下Ka(HX)<Ka(HY) B、加入10.00 mLNaOH溶液时,三种溶液中水的电离程度大小为:HX<HY<HZ C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) D、HY溶液中加入20.00 mLNaOH溶液,溶液中存在:c(OH-)=c(HY)+c(H+)7. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A、A B、B C、C D、D8. 在100℃时,100mL蒸馏水中c(OH﹣)=1×10﹣6mol•L﹣1 , 当改变下列条件之一时,c(OH﹣)仍然等于1×10﹣6mol•L﹣1的是( )①温度降低到25℃
②加入10﹣6mol NaOH固体,保持100℃
③加入10﹣6molNaCl,保持100℃
④蒸发丢掉50mL水,保持100℃
A、①② B、③④ C、①③ D、②④9. 已知电离常数:H2CO3>HCN>HCO3- , 氧化性:Cl2>Br2>Fe3+>I2。下列有关叙述中正确的是( )A、向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- B、向NaCN溶液中通入少量CO2的离子方程式:CN-+CO2+H2O=HCN+HCO3- C、向溴水中加入足量氯化亚铁溶液,混合溶液变为无色 D、0.1mol/L HCN溶液,加水稀释,c(H+)/(HCN)将变小10. 常温下将NaOH溶液滴加到己二酸 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是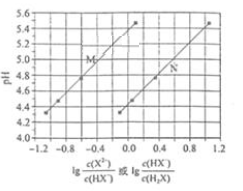 A、 的数量级为 B、曲线N表示pH与 的变化关系 C、NaHX溶液中 D、当混合溶液呈中性时,11. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A、 的数量级为 B、曲线N表示pH与 的变化关系 C、NaHX溶液中 D、当混合溶液呈中性时,11. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动12. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )
A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动12. 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )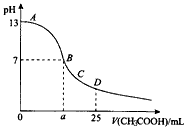 A、A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B、B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) C、C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)13. 在0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )A、加入少量CH3COONH4固体,平衡不移动,c(H+)不变 B、加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小 C、加水,平衡向正向移动,c(CH3COOH)/ c(CH3COO-)增大 D、通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少14. 下列有关电解质溶液的说法正确的是( )A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 B、向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 减小 C、向一定浓度的醋酸溶液中加水稀释,则溶液中 增大 D、40℃时,在氨—水体系中不断通入CO2 , 随着CO2的通入, 不断增大
A、A、B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B、B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) C、C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D、D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)13. 在0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )A、加入少量CH3COONH4固体,平衡不移动,c(H+)不变 B、加入少量NaOH固体,平衡向正向移动,溶液中c(H+)减小 C、加水,平衡向正向移动,c(CH3COOH)/ c(CH3COO-)增大 D、通入少量 HCl气体,平衡逆向移动,溶液中c(H+)减少14. 下列有关电解质溶液的说法正确的是( )A、向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 B、向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中 减小 C、向一定浓度的醋酸溶液中加水稀释,则溶液中 增大 D、40℃时,在氨—水体系中不断通入CO2 , 随着CO2的通入, 不断增大二、实验探究题
-
15. 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
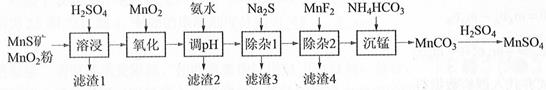
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
金属离子
Mn2+
Fe2+
Fe3+
Al3+
Mg2+
Zn2+
Ni2+
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)、“滤渣1”含有S和;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式。(2)、“氧化”中添加适量的MnO2的作用是将。(3)、“调pH”除铁和铝,溶液的pH范围应调节为~6之间。(4)、“除杂1”的目的是除去Zn2+和Ni2+ , “滤渣3”的主要成分是。
(5)、“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是。
(6)、写出“沉锰”的离子方程式。(7)、层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2 , 其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=。三、综合题
-
16. 现有物质①硫酸铜晶体 ②碳酸钙固体 ③纯磷酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧固态苛性钾 ⑨氨水 ⑩熟石灰固体 ⑪液态HCl ⑫液态CH3COOH,
按下列要求填空。
(1)、属于强电解质的是(填序号,下同);(2)、属于弱电解质的是;(3)、属于非电解质的是;(4)、既不是电解质,又不是非电解质的是;(5)、能导电的是。17. 某工业废液中含有Cu2+、Mg2+、Zn2+等离子,为将其回收利用,再采用了如下工艺: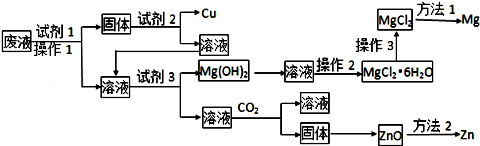
所用试剂在下列试剂中选择
①铁粉 ②锌粉 ③稀HNO3 ④稀H2SO4 ⑤稀HCl ⑥稀氨水 ⑦NaOH溶液 ⑧石灰水
请回答下列问题:(提示:锌的氧化物、氢氧化物性质与铝的相似)
(1)、试剂1、试剂2、试剂3分别可以是、、(填编号)(2)、操作2是、、(3)、操作3是
-