专题14:原子结构及性质
试卷更新日期:2019-10-31 类型:一轮复习
一、单选题
-
1. 反应NH4Cl+NaNO2=NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是( )A、中子数为18的氯原子: B、N2的结构式:N=N C、Na+的结构示意图:
 D、H2O的电子式:
D、H2O的电子式: 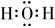 2. 下列各组原子中,彼此化学性质一定相似的是( )A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C、最外层都只有一个电子的X、Y原子 D、2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子3. 下列图像中所发生的现象与电子的跃迁无关的是( )A、燃放烟花
2. 下列各组原子中,彼此化学性质一定相似的是( )A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 C、最外层都只有一个电子的X、Y原子 D、2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子3. 下列图像中所发生的现象与电子的跃迁无关的是( )A、燃放烟花 B、霓虹灯广告
B、霓虹灯广告  C、燃烧蜡烛
C、燃烧蜡烛  D、平面镜成像
D、平面镜成像  4. 下列说法或有关化学用语的表达错误的是( )A、在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 B、核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 C、Ca2+离子基态电子排布式为1s22s22p63s23p6 D、氧元素基态原子的电子排布图为
4. 下列说法或有关化学用语的表达错误的是( )A、在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量 B、核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量 C、Ca2+离子基态电子排布式为1s22s22p63s23p6 D、氧元素基态原子的电子排布图为 5. 下列叙述正确的是( )A、 He 和 He 互为同位素,分别含有 3 和 4 个中子 B、O2 和 O3 互为同素异形体,同等质量时,所含电子数相同 C、1 mol 重水与 1 mol 水中,中子数比为 2∶1 D、1 mol 乙烷和 1 mol 乙烯中,共用电子对数相同6. 在核电荷数为26的元素Fe的原子核外3d、4s 轨道内,下列电子排布图正确的是( )
5. 下列叙述正确的是( )A、 He 和 He 互为同位素,分别含有 3 和 4 个中子 B、O2 和 O3 互为同素异形体,同等质量时,所含电子数相同 C、1 mol 重水与 1 mol 水中,中子数比为 2∶1 D、1 mol 乙烷和 1 mol 乙烯中,共用电子对数相同6. 在核电荷数为26的元素Fe的原子核外3d、4s 轨道内,下列电子排布图正确的是( )
A、 B、
B、 C、
C、 D、
D、 7. 同周期有下列电子排布式的原子中,第一电离能最小的是( )A、ns2np3 B、ns2np4 C、ns2np5 D、ns2np68. 下列关于 Pt与 Pt的说法正确的是( )A、 Pt与 Pt是同一种核素 B、 Pt与 Pt的质量数相同 C、 Pt与 Pt互为同位素 D、 Pt与 Pt的中子数均为789. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、1mol硝基(-NO2)与46g二氧化氮(NO2)所含的电子数均为23NA B、0.1mol/L(NH4)2SO4溶液与0.2 mol/LNH4Cl溶液中的NH4+数目相同 C、标准状况下,2.24L三氯甲烷中含碳氯共价键的数目为0.3NA D、向FeI2溶液中通入适量Cl2 , 当有1 mol Fe2+被氧化时,转移的电子数为NA10. 下列说法中正确的是( )A、氢原子中只有1个电子,故氢原子只有一个轨道 B、在d轨道中电子排布成
7. 同周期有下列电子排布式的原子中,第一电离能最小的是( )A、ns2np3 B、ns2np4 C、ns2np5 D、ns2np68. 下列关于 Pt与 Pt的说法正确的是( )A、 Pt与 Pt是同一种核素 B、 Pt与 Pt的质量数相同 C、 Pt与 Pt互为同位素 D、 Pt与 Pt的中子数均为789. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、1mol硝基(-NO2)与46g二氧化氮(NO2)所含的电子数均为23NA B、0.1mol/L(NH4)2SO4溶液与0.2 mol/LNH4Cl溶液中的NH4+数目相同 C、标准状况下,2.24L三氯甲烷中含碳氯共价键的数目为0.3NA D、向FeI2溶液中通入适量Cl2 , 当有1 mol Fe2+被氧化时,转移的电子数为NA10. 下列说法中正确的是( )A、氢原子中只有1个电子,故氢原子只有一个轨道 B、在d轨道中电子排布成 而不能排布成
而不能排布成  ,其最直接的根据是泡利不相容原理
C、原子轨道与电子云都是用来描述电子运动状态的
D、原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子,其对应元素一定位于同一周期
11. 磷原子核外3p亚层中的电子,不相同的是( )A、能量 B、电子云形状 C、电子云伸展方向 D、自旋方向
,其最直接的根据是泡利不相容原理
C、原子轨道与电子云都是用来描述电子运动状态的
D、原子核外的M层上的s能级和p能级都填满了电子,而d轨道上尚未排有电子的两种原子,其对应元素一定位于同一周期
11. 磷原子核外3p亚层中的电子,不相同的是( )A、能量 B、电子云形状 C、电子云伸展方向 D、自旋方向二、填空题
-
12.
下列原子或离子的电子排布的表示方法中,正确的是 , 违反了能量最低原理的是 , 违反洪特规则的是 .
①Ca2+:1s22s22p63s23p6
②F﹣:1s22s23p6
③

④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦

三、综合题
-
13. A,B,C,D,E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:(1)、写出C元素基态原子的电子排布式:。(2)、用电子排布图表示D元素原子的价电子:。(3)、元素B与D的电负性的大小关系是BD(填“>”“<”或“=”,下同),E与C的第一电离能大小关系是EC。(4)、写出元素E和C的最高价氧化物对应的水化物之间反应的离子方程式。14. VA、VIIA族单质及化合物在生产生活中有着重要的作用。(1)、N、P位于同一主族,NH3、PH3分子结构如下图所示:

①NH3和PH3中,N、P原子杂化方式相同,但H-N-H间的夹角比H-P-H间的大,其主要原因是。
②NH3比PH3易液化,其主要原因是。
(2)、基态氟原子核外电子的运动状态有种,有种不同能量的原子轨道。(3)、N与F可形成化合物N2F2 , 下列有关N2F2的说法正确的是(填字母)。a.分子中氮原子的杂化轨道类型为sp2
b.其结构式为F-N≡N一F
c.1mol N2F2含有的σ键的数目为4NA
15. X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:(1)、Q的基态原子的价层电子排布式为。(2)、X、Y、Z、W四种元素中,电负性最大的是(填元素符号,下同);同周期元素中,第一电高能介于Y 和Z之间的有。(3)、Y 和W的氯化物熔点高的是(填化学式),原因是;与Z的低价氯化物互为等电子体的离子是(填离子符号)。(4)、咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是 , 分子中氮原子的杂化类型有。 (5)、已知WX的密度为3.25 g/cm3 , 单元晶胞边长481pm,经计算可确定该单元晶胞中含有个WX,说明在形成晶体时,半径大的粒子先进行了方式的堆积,晶胞中距离W最近的X有个。16. 我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:(1)、氮原子价层电子的轨道表达式(电子排布图)为。(2)、N元素和O元素的第一电离能较大的是(填元素符号)。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物, N2H4分子中氮原子轨道的杂化类型是。(5)、H3O+中H—O—H键角比H2O中H—O—H键角大,原因为。(6)、R中两种阳离子的相同之处为_________(填标号)。A、中心原子的杂化轨道类型 B、中心原子的价层电子对数 C、空间构型 D、共价键类型(7)、R的晶体密度为d g·cm−3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。17. 第三代半导体材料氮化家(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:(1)、基态Ga原子价层电子的轨道表达式为 , 第一电离能介于N和B之间的第二周期元素有种。(2)、HCN分子中ο键与π键的数目之比为 , 其中ο键的对称方式为。与CN-互为等电子体的分子为。(3)、NaN3的是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为。NF3的空间构型为。(4)、GaN、Gap、GaAs都是很好的半导体材料,品体类型与品体硅类似,熔点如下表所示,分析其变化原因。
(5)、已知WX的密度为3.25 g/cm3 , 单元晶胞边长481pm,经计算可确定该单元晶胞中含有个WX,说明在形成晶体时,半径大的粒子先进行了方式的堆积,晶胞中距离W最近的X有个。16. 我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:(1)、氮原子价层电子的轨道表达式(电子排布图)为。(2)、N元素和O元素的第一电离能较大的是(填元素符号)。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物, N2H4分子中氮原子轨道的杂化类型是。(5)、H3O+中H—O—H键角比H2O中H—O—H键角大,原因为。(6)、R中两种阳离子的相同之处为_________(填标号)。A、中心原子的杂化轨道类型 B、中心原子的价层电子对数 C、空间构型 D、共价键类型(7)、R的晶体密度为d g·cm−3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。17. 第三代半导体材料氮化家(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:(1)、基态Ga原子价层电子的轨道表达式为 , 第一电离能介于N和B之间的第二周期元素有种。(2)、HCN分子中ο键与π键的数目之比为 , 其中ο键的对称方式为。与CN-互为等电子体的分子为。(3)、NaN3的是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为。NF3的空间构型为。(4)、GaN、Gap、GaAs都是很好的半导体材料,品体类型与品体硅类似,熔点如下表所示,分析其变化原因。GaN
GaP
GaAs
熔点
1700℃
1480℃
1238℃
(5)、Ga晶胞结构如下图所示。已知六核柱底边边长为acm,阿伏加德罗常数的值NA。
①品胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为:
②GaN的密度为g·cm-3(用a、NA表示)。
-