专题12:氮族元素及其化合物
试卷更新日期:2019-10-31 类型:一轮复习
一、单选题
-
1. 我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”指( )A、氨水 B、硝酸 C、醋 D、卤水2. 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。
下列各组物质:①Cu和HNO3溶液 ②Cu和FeCl3溶液 ③Zn与H2SO4溶液 ④Fe和HCl
溶液由于浓度不同而能发生不同氧化还原反应的是( )
A、③④ B、①③ C、①② D、①③④3. 实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是( )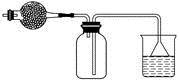 A、氯气 B、氨气 C、氢气 D、二氧化氮4. 将充满二氧化氮的试管倒立于盛有水的水槽中,充分放置后的现象正确的是( )A、
A、氯气 B、氨气 C、氢气 D、二氧化氮4. 将充满二氧化氮的试管倒立于盛有水的水槽中,充分放置后的现象正确的是( )A、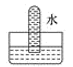 B、
B、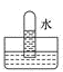 C、
C、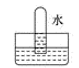 D、
D、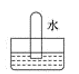 5. 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+):c(Fe3+)=3:2,则参加反应的Fe和HNO3的物质的量之比为( )
5. 将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+):c(Fe3+)=3:2,则参加反应的Fe和HNO3的物质的量之比为( )
A、5:12 B、5:16 C、2:3 D、3:26. 在烧瓶中加入铜片和稀硝酸以制取较纯净的一氧化氮,反应开始后发现烧瓶中充满红棕色气体,这时的操作应是( )A、立即接上收集容器,用向下排空气法收集 B、立即用排空气法收集 C、待烧瓶中红棕色气体消失后,用排水法收集 D、待烧瓶中的红棕色气体消失后,用向上排空气法收集7. 检验某晶体是铵盐时,将待测物取出少量放在试管中后( )A、加烧碱溶液,加热,用湿润红色石蕊试纸在管口检验 B、直接加热,用湿润红色石蕊试纸在管口检验 C、加烧碱溶液,加热,向试管中滴加紫色石蕊试液 D、加水溶解,滴加无色酚酞试液,观察是否变红8. 下列关于实验室制取NH3的叙述正确的是( )A、用N2和H2作反应物 B、用碱石灰干燥 C、用向上排空气法收集 D、用湿润的蓝色石蕊试纸验满9. 下列药品和装置合理且能完成相应实验的是( )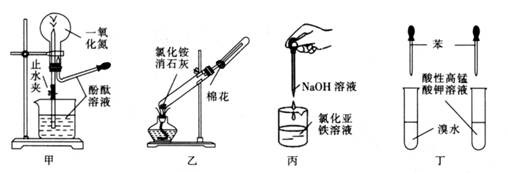 A、甲图为喷泉实验 B、乙图为实验室制取并收集氨气 C、丙图为制备氢氧化亚铁的实验 D、丁图为验证苯中是否有碳碳双键的实验10. 硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
A、甲图为喷泉实验 B、乙图为实验室制取并收集氨气 C、丙图为制备氢氧化亚铁的实验 D、丁图为验证苯中是否有碳碳双键的实验10. 硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3 N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是( )
A、混合气体中V(N2O4) = 0.336 L B、混合气体中n(NO)∶n(NO2) = 1∶5 C、NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5 D、如采用氨的催化氧化法处理,理论消耗n(NH3) = mol11. 使用单质铜制硝酸铜,耗用原料最经济,而且对环境几乎没有污染的是( )A、Cu Cu(NO3)2 B、Cu CuO Cu(NO3)2 C、Cu Cu(NO3)2 D、Cu CuCl2 Cu(NO3)212. 向50 mL 14.0 mol•L﹣1浓硝酸中加入足量铜,充分反应后共收集到标准状况下4.48 L NO和NO2混合气体(不考虑NO2与N2O4的相互转化),则参加反应铜的质量为( )A、6.4g B、12.8g C、16.0g D、19.2g13. 在4 mol/L的硫酸和2 mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后最多可收集到标准状况下的气体的体积为( )A、89.6mL B、112mL C、168mL D、224mL14. 无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为() A、NH3、NO、CO2 B、NH3、NO2、N2 C、NH3、NO2、CO2 D、NO、CO2、N215. 在一定条件下,将NO2和O2的混合气体12mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为()
A、NH3、NO、CO2 B、NH3、NO2、N2 C、NH3、NO2、CO2 D、NO、CO2、N215. 在一定条件下,将NO2和O2的混合气体12mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为()①1.2 mL ②2.4 mL ③3 mL ④4 mL
A、①④ B、③④ C、②③ D、①②二、实验探究题
-
16. 下图是实验室制取氮气的气体发生装置。请结合所学知识,回答下列问题;
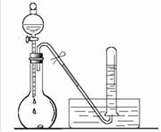
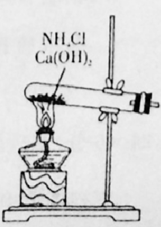 (1)、完成实验室制取氩气的化学方程式:2NH4Cl+Ca(OH)2 +2NH3↑+2H2O(2)、验证氨气是否已经收集满的方法是 (填字母代号)。A、将湿润的红色石蕊试纸靠近集气瓶口 B、将带火星的小木条放在集气瓶口(3)、若有10.7g氯化铵(摩尔质量是53.5g/mol)参加反应,则产生的氨气在标准状况下的体积为L。(4)、用收集满氨气的烧瓶做喷泉实验,装置如图所示(胶头滴管内预先吸入水,烧杯内盛有酚酞溶液),观察到产生红色喷泉,绕瓶内几乎充满红色液体。这说明氨气 , 氨水显性。
(1)、完成实验室制取氩气的化学方程式:2NH4Cl+Ca(OH)2 +2NH3↑+2H2O(2)、验证氨气是否已经收集满的方法是 (填字母代号)。A、将湿润的红色石蕊试纸靠近集气瓶口 B、将带火星的小木条放在集气瓶口(3)、若有10.7g氯化铵(摩尔质量是53.5g/mol)参加反应,则产生的氨气在标准状况下的体积为L。(4)、用收集满氨气的烧瓶做喷泉实验,装置如图所示(胶头滴管内预先吸入水,烧杯内盛有酚酞溶液),观察到产生红色喷泉,绕瓶内几乎充满红色液体。这说明氨气 , 氨水显性。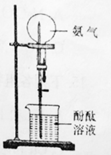 17. 现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。
17. 现用下列装置(仪器可重复使用)制备PH3并证明PH3具有强还原性和热不稳定性。已知: ①标准状态时PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃; ②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;③乙醚是一种易挥发的液体,沸点34.6℃,能溶解白磷。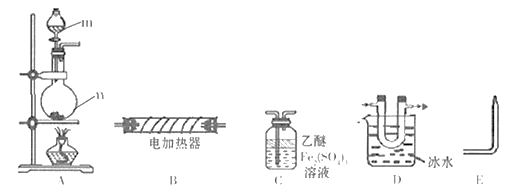 (1)、仪器m的名称为 , 装置C名称为。(2)、实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3 , 反应的化学方程式为。(3)、用装置A制取PH3 , 实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是。(4)、将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有性,装置C中发生的化学反应方程式为 , 点燃E处气体的目的为。(5)、将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
(1)、仪器m的名称为 , 装置C名称为。(2)、实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3 , 反应的化学方程式为。(3)、用装置A制取PH3 , 实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是。(4)、将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有性,装置C中发生的化学反应方程式为 , 点燃E处气体的目的为。(5)、将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为A D E( 在“ ”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是。
三、综合题
-
18. 某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测得)如图所示。
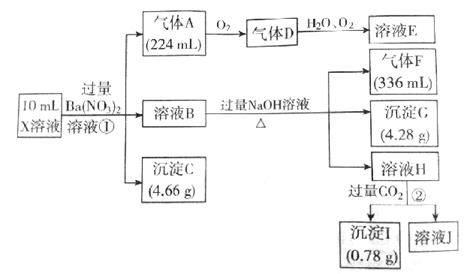 (1)、通过上述实验过程,一定不存在的离子是(2)、反应①中生成A的离子方程式为:(3)、若测得X溶液中C(H+)=5mol/L,则X溶液中(填“含”或“不含”)Fe3+ ,
(1)、通过上述实验过程,一定不存在的离子是(2)、反应①中生成A的离子方程式为:(3)、若测得X溶液中C(H+)=5mol/L,则X溶液中(填“含”或“不含”)Fe3+ ,C(Fe3+)=(若填不含,则不需要计算)mol/L,X溶液中 C(Cl-)=mol/L
19. N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)、N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为。(2)、NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为NO+NO2+2OH−=2 +H2O
2NO2+2OH−= + +H2O
①下列措施能提高尾气中NO和NO2去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
(3)、NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。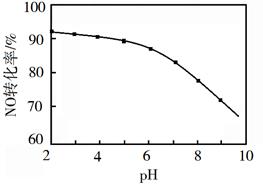
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是。
20. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。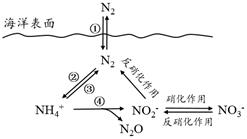 (1)、海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是(填图中数字序号)。(2)、下列关于海洋氮循环的说法正确的是(填字母序号)。
(1)、海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是(填图中数字序号)。(2)、下列关于海洋氮循环的说法正确的是(填字母序号)。a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)、有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:NH4+ + 5 O2=2 NO2- + H+ + +(4)、有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:温度/℃
样本氨氮含量/mg[
处理24h
处理48h
氨氮含量/mg
氨氮含量/mg
20
1008
838
788
25
1008
757
468
30
1008
798
600
40
1008
977
910
硝化细菌去除氨氮的最佳反应温度是 , 在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。
(5)、为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。图是电解产物氧化工业废水中氨氮(NH4+)的示意图。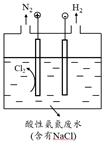
①阳极的电极反应式:;
②写出电解产物氧化去除氨氮的离子方程式:;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将(填“增大”、“不变”或“减小”)。
21. A,B,C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。 (1)、若A是一种黄色单质固体,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质与二氧化碳气体的反应。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为。(3)、若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:
(1)、若A是一种黄色单质固体,则B→C的化学方程式为。(2)、若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质与二氧化碳气体的反应。将C长期露置于空气中,最后将变成物质D。现有D和NaHCO3的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38 g,D的质量分数为。(3)、若C是红棕色气体,A可能是一种能使湿润的红色石蕊试纸变蓝的气体。下图是实验室制取A气体的装置,请结合所学知识,回答下列问题:
①验证A是否已经收集满的方法是(任写一种)。
②若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
③试写出C与水反应的化学方程式 , 反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)
四、推断题
-
22. 已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物未给出,且未注明反应条件):
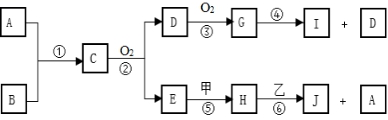 (1)、已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每消耗3mol G,生成I的物质的量为mol。(2)、实验室制取C物质的化学方程式为:。(3)、已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:。当反应中转移3mol电子时,生成A在标准状况下的体积为L
(1)、已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每消耗3mol G,生成I的物质的量为mol。(2)、实验室制取C物质的化学方程式为:。(3)、已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:。当反应中转移3mol电子时,生成A在标准状况下的体积为L