专题10:无机非金属材料
试卷更新日期:2019-10-31 类型:一轮复习
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、高纯硅可用于制作光感电池 B、铝合金大量用于高铁建设 C、活性炭具有除异味和杀菌作用 D、碘酒可用于皮肤外用消毒2. 物质的主要成分不属于硅酸盐的是()A、合成黏合剂 B、水玻璃 C、瓷砖 D、钢化玻璃3. 化学与生活密切相关。下列叙述不正确的是( )A、二氧化硅是将太阳能转变为电能的常用材料 B、中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 C、维生素 C 易被氧气氧化,用作食品抗氧化剂 D、汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土4. 高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备,下列说法正确的是( )
SiO2 Si(粗) SiHCl3 Si(纯)
A、步骤①的化学方程式为SiO2+C Si+CO2↑ B、步骤①、②、③中每生成或反应1 mol Si,转移2 mol电子 C、二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 D、SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏可提纯SiHCl35. 下列说法正确的是( )A、由反应SiO2+4HF=SiF4↑+2H2O,可知SiO2是碱性氧化物 B、浓硝酸在光照下颜色变黄,说明浓硝酸见光易分解 C、SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 D、SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好6. 将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )A、 B、
B、 C、
C、 D、
D、 7. 下列有关说法正确的是( )
7. 下列有关说法正确的是( )①二氧化硅可与NaOH溶液反应,因此可用NaOH溶液雕刻玻璃;
② 明矾溶于水可水解生成Al(OH)3胶体,因此可以用明矾对自来水进行杀菌消毒;
③ 可用蒸馏法、电渗析法、离子交换法等对海水进行淡化;
④ 从海带中提取碘只需用到蒸馏水、H2O2溶液和四氯化碳三种试剂;
⑤地沟油可用来制肥皂、提取甘油或者生产生物柴油;
⑥石英玻璃、Na2O·CaO·6SiO2、淀粉、氨水的物质类别依次为纯净物、氧化物、混合物、弱电解质。
A、③⑤⑥ B、①④⑤ C、除②外都正确 D、③⑤8. 能证明硅酸的酸性弱于碳酸酸性的实验事实是( )A、CO2溶于水形成碳酸,SiO2难溶于水 B、高温下SiO2与碳酸盐反应生成CO2 C、CO2通入可溶性硅酸盐中析出硅酸沉淀 D、HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀9. 化学与生活、生产密切相关。下列说法正确的是( )A、硫酸铁净水的原理和漂白粉消毒的原理相同 B、汽车尾气中的氮氧化物是汽油不完全燃烧造成的 C、研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 D、应用高纯度单质硅制成光导纤维,可提高信息传输速度10. 下列说法错误的是( )A、石英是由硅原子和氧原子构成的原子晶体,每个原子的最外层都具有8电子稳定结构 B、Na2O是离子晶体,其溶于水生成NaOH的过程中既有离子键的断裂又有共价键的形成 C、现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 D、NH5的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既具有离子键又具有共价键的离子化合物11. 下列关于硅及其化合物的说法正确的是( )A、硅酸盐中的阴离子都是SiO32- B、单质硅可用于制造光导纤维 C、二氧化硅既可以与烧碱溶液反应又能与氢氟酸反应,故属于两性氧化物 D、Na2SiO3是最简单的硅酸盐,其水溶液可用作木材防火剂12. 下列关于工业生产的说法中错误的是()A、玻璃、水泥、陶瓷工业中,石灰石都是主要的生产原料 B、在氯碱工业中,电解槽被离子交换膜隔成阴极室和阳极室 C、在合成氨工业中,采用循环操作提高原料利用率 D、在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳13. 下列物质转化在给定条件下每一步都能实现的是()A、Si SiO2
SiO2  H2SiO3
B、Mg(OH)2
H2SiO3
B、Mg(OH)2  MgCl2(aq)
MgCl2(aq)  Mg
C、Al2O3
Mg
C、Al2O3  AlCl3(aq)
AlCl3(aq)  无水AlCl3
D、CH3CHO
无水AlCl3
D、CH3CHO  CH3COOH
CH3COOH  CH3COOCH3
14. 将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是()A、硅酸钠 B、碳酸钠,硅酸钠 C、碳酸钠,二氧化硅 D、二氧化硅15. 下列物质间的每步转化只需通过一步反应就能实现的是( )A、Fe→Fe2O3→Fe(OH)3→FeCl3 B、Al→Al(OH)3→Al2O3→NaAlO2 C、Na→Na2O2→Na2CO3→NaOH D、Si→SiO2→H2SiO3→Na2SiO3
CH3COOCH3
14. 将足量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是()A、硅酸钠 B、碳酸钠,硅酸钠 C、碳酸钠,二氧化硅 D、二氧化硅15. 下列物质间的每步转化只需通过一步反应就能实现的是( )A、Fe→Fe2O3→Fe(OH)3→FeCl3 B、Al→Al(OH)3→Al2O3→NaAlO2 C、Na→Na2O2→Na2CO3→NaOH D、Si→SiO2→H2SiO3→Na2SiO3二、填空题
-
16.(1)、把对应物质的字母代码填入括号内.
A.水玻璃
B.明矾
C.次氯酸钙
D.过氧化钠 E.新制氯水 F.小苏打
①能使石蕊试液先变红后褪色。
②能做木材防火剂。
③能做处理胃酸过多的一种药剂。
(2)、把下列现象中硫酸所表现出来的性质填写在空白处。①用玻璃棒蘸浓硫酸滴在纸上时,纸变黑。浓硫酸表现性。
②在常温下可以用铁、铝制容器盛装冷的浓硫酸。浓硫酸表现性。
③盛有浓硫酸的烧杯敞口放置一段时间后,质量增加。浓硫酸表现性。
三、综合题
-
17. 高纯二氧化硅可用来制造光纤。某稻壳灰的成分为

通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)、根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是。(2)、步骤①中涉及SiO2的离子反应方程式为。(3)、滤渣A的成分有和(填化学式)。(4)、滤渣B的成分是(填化学式)。(5)、过滤所需的玻璃仪器除烧杯和玻璃棒外,还有。18. 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
(1)、Ⅰ.硅粉与 在300℃时反应生成 气体和 ,放出 热量,该反应的热化学方程式为。 的电子式为。(2)、Ⅱ.将 氢化为 有三种方法,对应的反应依次为:①
②
③
氢化过程中所需的高纯度 可用惰性电极电解 溶液制备,写出产生 的电极名称(填“阳极”或“阴极”),该电极反应方程式为。
 (3)、已知体系自由能变 , 时反应自发进行。三个氢化反应的 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是;相同温度下,反应②比反应①的 小,主要原因是。(4)、不同温度下反应②中 转化率如图2所示。下列叙述正确的是(填序号)。
(3)、已知体系自由能变 , 时反应自发进行。三个氢化反应的 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是;相同温度下,反应②比反应①的 小,主要原因是。(4)、不同温度下反应②中 转化率如图2所示。下列叙述正确的是(填序号)。a.B点: b. :A点 点 c.反应适宜温度: ℃
(5)、反应③的 (用 , 表示)。温度升高,反应③的平衡常数 (填“增大”、“减小”或“不变”)。(6)、由粗硅制备多晶硅过程中循环使用的物质除 、 和 外,还有(填分子式)。19. 本题为《化学与生活》(选修1)选做题,每空2分,共20分。请根据题意,选择恰当的选项用字母代号填空。
(1)、中国的高铁技术居于国际领先地位。①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于。
A.金属材料B.无机非金属材料C.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是。
A.铜B.单质硅C.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和 。
A.石灰石B.粗盐C.纯碱
④高铁轨道建设铺设的铁轨属于(填“金属铁”或“铁合金”)。
(2)、煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。①控制燃煤产生的排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为 , 煤的干馏属于(填“化学变化”或“物理变化”)。
(3)、营养均衡有利于身体健康。①人体内提供能量的主要营养物质为 、糖类和蛋白质。
②维生素是人体需要的营养物质。图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和 反应释放出了气体。
20. A,B,C,D,E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。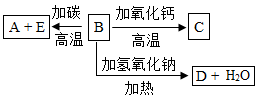
请回答:
(1)、形成单质A的原子的结构示意图为。(2)、E的化学式为。(3)、B与氢氧化钠反应生成D和H2O的化学方程式是。(4)、在D的溶液中通入过量CO2气体的离子方程式。(5)、下列说法正确的是( )A、水泥、玻璃、石英玻璃等都是传统硅酸盐材料。 B、高纯度的硅单质广泛用于制作光导纤维。 C、化学分析中常用到的分子筛是硅酸盐材料。 D、熔融烧碱不能选用陶瓷坩埚。
-