浙江省温州十校联合体2018-2019学年高一上学期化学期末考试试卷
试卷更新日期:2019-10-31 类型:期末考试
一、单选题
-
1. 下列属于酸性氧化物的是( )A、Mg(OH)2 B、H2SO4 C、SiO2 D、NaClO2. 下列仪器名称错误的是( )A、量筒
 B、圆底烧瓶
B、圆底烧瓶  C、容量瓶
C、容量瓶  D、分液漏斗
D、分液漏斗  3. 下列表示正确的是( )A、NaCl的摩尔质量:58.5g B、有18个中子的氯原子的符号: C、“钡餐”的化学式:BaCO3 D、NaOH的电离方程式:NaOH Na++ OH-4. 下列物质属于非电解质的是( )A、醋酸 B、氯化钠 C、氯水 D、蔗糖5. 下列物质投入水中能发生化学反应,且水做氧化剂的是( )A、钠 B、氧化钠 C、碳酸钠 D、氯化钠6. 下列说法正确的是( )A、原子结构模型演变历史可以表示为:
3. 下列表示正确的是( )A、NaCl的摩尔质量:58.5g B、有18个中子的氯原子的符号: C、“钡餐”的化学式:BaCO3 D、NaOH的电离方程式:NaOH Na++ OH-4. 下列物质属于非电解质的是( )A、醋酸 B、氯化钠 C、氯水 D、蔗糖5. 下列物质投入水中能发生化学反应,且水做氧化剂的是( )A、钠 B、氧化钠 C、碳酸钠 D、氯化钠6. 下列说法正确的是( )A、原子结构模型演变历史可以表示为: B、14C与14N互为同位素
C、迄今为止人们发现了118种元素,即有118种核素
D、元素性质的周期性变化取决于元素原子核外电子排布的周期性变化
7. 下列有关物质性质和用途的说法,错误的是( )A、硅酸钠可作建筑行业的黏合剂 B、Na-K合金可作为快中子反应堆的导热剂 C、晶体硅是在通信工程中制作光导纤维的主要原料 D、氧化铁常用于红色油漆和涂料8. 化学知识可以帮助解决日常生活中遇到的许多问题,下列说法错误的是( )A、胃酸过多的病人,可以服用碳酸氢钠来中和胃酸 B、明矾有吸附性,可用于自来水的杀菌消毒 C、溴化银见光易分解,是一种重要的感光材料,是胶卷中必不可少的成分 D、Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂9. 下列说法错误的是( )A、工业上可用铁制容器贮存浓硫酸 B、装NaOH溶液的试剂瓶使用橡皮塞 C、漂白粉在空气中不易变质,可敞口保存 D、少量钠保存在煤油中10. 下列说法正确的是( )A、钠在空气中燃烧只生成白色固体 B、钠在氯气中燃烧呈现苍白色火焰 C、SO2使紫色石蕊试液先变红后褪色 D、铜在氯气中燃烧生成棕黄色烟11. 下列有关工业生产中,错误的是( )A、制氯气:电解饱和食盐水 B、硫酸工业:在接触室中SO2氧化为SO3 C、炼铁:用CO在高温下还原铁矿石中的铁 D、制钛:钠从四氯化钛水溶液中置换出钛12. 下列物质中,不能由金属跟非金属单质直接化合得到的是( )A、Na2O2 B、NaCl C、FeCl2 D、Fe3O413. 已知还原性:B- > C-> D-,下列方程式错误的是( )A、2C-+B2=2B-+C2 B、2C-+D2=2D-+C2 C、2B-+D2=2D-+B2 D、2B-+C2=2C-+B214. 下列说法错误的是( )A、用火箭燃料发射“天宫二号”的过程中,发生了氧化还原反应 B、“何意百炼钢,化为绕指柔”,其中钢指的是铁的合金 C、“声如罄、薄如纸”,瓷器的原料高岭土[Al2Si2O5(OH)4],可表示为:Al2O3·2SiO2·2H2O D、“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属化学变化15. 下列各组离子,在强酸性溶液中能大量共存的是( )A、Na+、K+、Ca2+、HCO3- B、NO3-、Cl-、Na+、Ag+ C、Mg2+、Na+、Cl-、OH- D、Cu2+、K+、SO42-、Cl-16. 下列离子方程式正确的是( )A、金属钠和水反应:Na+2H2O =Na++2OH-+H2↑ B、氢氧化钠溶液中通入少量SO2:SO2+2OH-= SO32-+H2O C、大理石与醋酸反应:CaCO3+2H+=CO2↑+H2O + Ca2+ D、硫酸铜溶液与氢氧化钡溶液:Ba2++SO42-=BaSO4 ↓17. 某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )A、Na+ B、OH- C、Cl- D、SO42-18. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法错误的是( )
B、14C与14N互为同位素
C、迄今为止人们发现了118种元素,即有118种核素
D、元素性质的周期性变化取决于元素原子核外电子排布的周期性变化
7. 下列有关物质性质和用途的说法,错误的是( )A、硅酸钠可作建筑行业的黏合剂 B、Na-K合金可作为快中子反应堆的导热剂 C、晶体硅是在通信工程中制作光导纤维的主要原料 D、氧化铁常用于红色油漆和涂料8. 化学知识可以帮助解决日常生活中遇到的许多问题,下列说法错误的是( )A、胃酸过多的病人,可以服用碳酸氢钠来中和胃酸 B、明矾有吸附性,可用于自来水的杀菌消毒 C、溴化银见光易分解,是一种重要的感光材料,是胶卷中必不可少的成分 D、Na2O2吸收CO2产生O2 ,可用作呼吸面具供氧剂9. 下列说法错误的是( )A、工业上可用铁制容器贮存浓硫酸 B、装NaOH溶液的试剂瓶使用橡皮塞 C、漂白粉在空气中不易变质,可敞口保存 D、少量钠保存在煤油中10. 下列说法正确的是( )A、钠在空气中燃烧只生成白色固体 B、钠在氯气中燃烧呈现苍白色火焰 C、SO2使紫色石蕊试液先变红后褪色 D、铜在氯气中燃烧生成棕黄色烟11. 下列有关工业生产中,错误的是( )A、制氯气:电解饱和食盐水 B、硫酸工业:在接触室中SO2氧化为SO3 C、炼铁:用CO在高温下还原铁矿石中的铁 D、制钛:钠从四氯化钛水溶液中置换出钛12. 下列物质中,不能由金属跟非金属单质直接化合得到的是( )A、Na2O2 B、NaCl C、FeCl2 D、Fe3O413. 已知还原性:B- > C-> D-,下列方程式错误的是( )A、2C-+B2=2B-+C2 B、2C-+D2=2D-+C2 C、2B-+D2=2D-+B2 D、2B-+C2=2C-+B214. 下列说法错误的是( )A、用火箭燃料发射“天宫二号”的过程中,发生了氧化还原反应 B、“何意百炼钢,化为绕指柔”,其中钢指的是铁的合金 C、“声如罄、薄如纸”,瓷器的原料高岭土[Al2Si2O5(OH)4],可表示为:Al2O3·2SiO2·2H2O D、“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属化学变化15. 下列各组离子,在强酸性溶液中能大量共存的是( )A、Na+、K+、Ca2+、HCO3- B、NO3-、Cl-、Na+、Ag+ C、Mg2+、Na+、Cl-、OH- D、Cu2+、K+、SO42-、Cl-16. 下列离子方程式正确的是( )A、金属钠和水反应:Na+2H2O =Na++2OH-+H2↑ B、氢氧化钠溶液中通入少量SO2:SO2+2OH-= SO32-+H2O C、大理石与醋酸反应:CaCO3+2H+=CO2↑+H2O + Ca2+ D、硫酸铜溶液与氢氧化钡溶液:Ba2++SO42-=BaSO4 ↓17. 某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+和M离子的物质的量之比为2∶4∶1∶1,则M离子可能是( )A、Na+ B、OH- C、Cl- D、SO42-18. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法错误的是( ) A、原子半径大小:X > Y > Z B、W、Y两种元素都能与氧元素形成化合物WO2、YO2 C、氧化物对应水化物的酸性: Z > Y > W D、Y能形成H2Y、H2YO4的化合物19. 下列说法正确的是( )A、等物质的量浓度的MgCl2溶液和CaCl2溶液中所含有的离子数相同 B、常温常压下,9gH2O含分子数0.5NA C、标准状况下,22.4L CCl4的物质的量是1mol D、标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA20. 下列装置或操作能达到实验目的的是( )A、
A、原子半径大小:X > Y > Z B、W、Y两种元素都能与氧元素形成化合物WO2、YO2 C、氧化物对应水化物的酸性: Z > Y > W D、Y能形成H2Y、H2YO4的化合物19. 下列说法正确的是( )A、等物质的量浓度的MgCl2溶液和CaCl2溶液中所含有的离子数相同 B、常温常压下,9gH2O含分子数0.5NA C、标准状况下,22.4L CCl4的物质的量是1mol D、标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA20. 下列装置或操作能达到实验目的的是( )A、 检验溶液中是否含有K+
B、
检验溶液中是否含有K+
B、 用激光笔照射Fe(OH)3胶体,产生丁达尔效应
C、
用激光笔照射Fe(OH)3胶体,产生丁达尔效应
C、 转移溶液
D、
转移溶液
D、 分离乙醇(沸点为78.3℃)和苯(沸点为80.1℃)的混合物
21. 下列说法正确的是( )A、向蔗糖(C12H22O11)固体中加入浓硫酸,蔗糖变黑,说明浓硫酸具有吸水性 B、在KI溶液中滴加氯水和CCl4 , 振荡、静置,上层溶液显紫红色 C、用氯水和淀粉溶液不能鉴别碘化钾和溴化钠 D、在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+22. 实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是( )A、称取40.0gNaOH固体 B、容量瓶水洗后未烘干直接使用 C、定容时俯视 D、摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐23. A,B,C,D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断错误的是 ( )
分离乙醇(沸点为78.3℃)和苯(沸点为80.1℃)的混合物
21. 下列说法正确的是( )A、向蔗糖(C12H22O11)固体中加入浓硫酸,蔗糖变黑,说明浓硫酸具有吸水性 B、在KI溶液中滴加氯水和CCl4 , 振荡、静置,上层溶液显紫红色 C、用氯水和淀粉溶液不能鉴别碘化钾和溴化钠 D、在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NH4+22. 实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是( )A、称取40.0gNaOH固体 B、容量瓶水洗后未烘干直接使用 C、定容时俯视 D、摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐23. A,B,C,D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断错误的是 ( )
选项
假设
结论
A
A为NaOH溶液
D可能是CO2
B
B为CO
C可能是CO2
C
C为FeCl2 ,D为Fe
A可能是盐酸
D
C为SO2
A可能是H2S
A、A B、B C、C D、D24. 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确的是( ) A、oa段反应的离子方程式为:H++OH-=H2O B、O点溶液中所含溶质的化学式为NaHCO3、Na2CO3 C、标准状况下,通入CO2的体积为4.48L D、原NaOH溶液的物质的量浓度为2.5mol•L﹣125. 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
A、oa段反应的离子方程式为:H++OH-=H2O B、O点溶液中所含溶质的化学式为NaHCO3、Na2CO3 C、标准状况下,通入CO2的体积为4.48L D、原NaOH溶液的物质的量浓度为2.5mol•L﹣125. 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
A、过程①加入的药品顺序为:Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤后加盐酸 B、过程②通过氧化还原反应可产生1种单质 C、在过程③中将MgCl2•6H2O直接灼烧得到MgCl2 D、在过程④、⑥反应中每氧化0.2molBr-需消耗标准状况下2.24LCl2二、填空题
-
26.(1)、化学与生产生活密切相关,请写出下列反应
①实验室制氯气(离子方程式)
②“腐蚀法”制作印刷电路板(化学方程式)并用双线桥表示该反应的电子转移数目和方向
(2)、K2FeO4可用作水处理剂,它可由以下反应制得:Cl2 + Fe(OH)3 + OH- = FeO4 2-+ Cl- + H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为
三、推断题
-
27. 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
 (1)、表中用于半导体材料的元素在周期表中的位置。(2)、写出短周期金属性最强的元素的离子结构示意图:。(3)、③、④、⑤三元素离子半径从大到小的顺序是填离子符号)。(4)、②、③、④的气态氢化物,稳定性最强的是填化学式)。(5)、设计实验证明⑤、⑥的金属性强弱。(6)、在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)
(1)、表中用于半导体材料的元素在周期表中的位置。(2)、写出短周期金属性最强的元素的离子结构示意图:。(3)、③、④、⑤三元素离子半径从大到小的顺序是填离子符号)。(4)、②、③、④的气态氢化物,稳定性最强的是填化学式)。(5)、设计实验证明⑤、⑥的金属性强弱。(6)、在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)①同族元素之间,则反应可能为。
②不同族元素之间,则反应可能为(以上反应各写一条化学方程式即可)。
(7)、将⑨的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。、、。 28. 某固体中可能含有Na+、K+、Mg2+、Ba2+、 SO42-、CO32-、SO32-、SiO32-等离子,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:
28. 某固体中可能含有Na+、K+、Mg2+、Ba2+、 SO42-、CO32-、SO32-、SiO32-等离子,将其配成100mL溶液。学生研究性学习小组为了确认其成分,设计并完成了如图所示实验:
请回答下列问题:
(1)、实验中最关键的“定容”操作:当液面接近容量瓶刻度线1-2cm处,再将容量瓶塞盖好,反复上下颠倒,摇匀。(2)、根据以上实验可得出:一定存在的离子是 , 一定不存在的离子是(3)、下列实验结论符合事实的是________________A、该固体中可能含有Na2SiO3、K2CO3 B、该固体中一定含有Na2SiO3、K2CO3 C、该固体中可能含有Na2SiO3、K2CO3、K2SO4 D、该固体中可能只含有Na2SiO3、Na2CO3四、综合题
-
29. 为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验。已知无色气体B能形成酸雨。请回答:
 (1)、X的化学式是。(2)、设计实验方案检验黄色溶液中的金属阳离子。(3)、将无色气体B通入黄色溶液A中,发现溶液变成浅绿色。请用离子方程式表示该反应
(1)、X的化学式是。(2)、设计实验方案检验黄色溶液中的金属阳离子。(3)、将无色气体B通入黄色溶液A中,发现溶液变成浅绿色。请用离子方程式表示该反应五、实验题
-
30. 某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
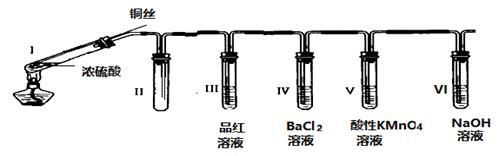
请回答:
(1)、连接好装置后,接下来的操作步骤是(2)、浓硫酸与铜丝反应的化学方程式为(3)、装置II的作用是(4)、下列说法正确的是________________A、反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色 B、试管III、V中溶液都会褪色,其褪色原理相同 C、取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4 D、试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替(5)、某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
六、计算题
-
31. 将8.00gCuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.88g;另一份固体用200mL某浓度的盐酸恰好溶解,则:(1)、混合物中CuO和Fe2O3的物质的量之比为:(2)、所用盐酸的物质的量浓度为
-
-
-