吉林省公主岭市2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-10-31 类型:期末考试
一、单选题
-
1. 将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是( )A、c(H+) B、Ka(HF) C、 D、2. 用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( )A、CuSO4 B、H2SO4 C、CuCl2 D、NaCl3. X、Y、Z、M、N代表五种金属。有以下化学反应:
①水溶液中:X+Y2+=X2++Y
②Z+2H2O(冷)=Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-=M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化,则这五种金属的活动性由弱到强的顺序是( )
A、M<N<Y<X<Z B、N<M<X<Y<Z C、N<M<Y<X<Z D、X<Z<N<M<Y4. 在下列各说法中,正确的是( )A、ΔH>0表示放热反应,ΔH<0表示吸热反应 B、热化学方程式中的化学计量数只表示物质的量,可以是分数 C、1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 D、1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热5. 已知298 K时,合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.0 kJ·mol-1 , 将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( )A、一定小于92.0 kJ B、一定大于92.0 kJ C、一定等于92.0 kJ D、无法确定6. 在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )A、CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1 B、CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1 C、CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 D、CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y) kJ·mol-17. 下列热化学方程式中ΔH表示可燃物燃烧热的是( )A、CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1 B、CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 C、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 D、H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-18. 对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )A、增大压强 B、升高温度 C、使用催化剂 D、多充入O29. 在恒温、体积为2 L的密闭容器中进行反应:2A(g) 3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )A、v(B)=0.03 mol·L-1·s-1 B、v(B)=0.045 mol·L-1·s-1 C、v(C)=0.03 mol·L-1·s-1 D、v(C)=0.06 mol·L-1·s-110. 在一定温度不同压强(P1<P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )A、 B、
B、 C、
C、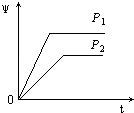 D、
D、 11. 符合图1、图2的反应是( )
11. 符合图1、图2的反应是( )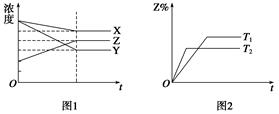 A、X+3Y 2Z ΔH>0 B、X+3Y 2Z ΔH<0 C、X+2Y 3Z ΔH<0 D、5X+3Y 4Z ΔH<012. 下图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A、X+3Y 2Z ΔH>0 B、X+3Y 2Z ΔH<0 C、X+2Y 3Z ΔH<0 D、5X+3Y 4Z ΔH<012. 下图是温度和压强对X+Y 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( ) A、上述可逆反应的正反应为放热反应 B、X、Y、Z均为气态 C、X和Y中只有一种为气态,Z为气态 D、上述反应的逆反应为吸热反应13. 某温度时,N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3 3/2H2+1/2N2的平衡常数为( )A、a-1/2 B、a1/2 C、 a D、a-214. 下列物质中属于电解质,但在给定条件下不能导电的是( )A、液态氯化氢 B、蔗糖 C、铝 D、稀硝酸15. 下列事实能说明亚硝酸是弱电解质的是( )
A、上述可逆反应的正反应为放热反应 B、X、Y、Z均为气态 C、X和Y中只有一种为气态,Z为气态 D、上述反应的逆反应为吸热反应13. 某温度时,N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3 3/2H2+1/2N2的平衡常数为( )A、a-1/2 B、a1/2 C、 a D、a-214. 下列物质中属于电解质,但在给定条件下不能导电的是( )A、液态氯化氢 B、蔗糖 C、铝 D、稀硝酸15. 下列事实能说明亚硝酸是弱电解质的是( )①25℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1 HNO2溶液的pH=2.1
A、①②③ B、②③④ C、①④ D、①②④16. 把1mL0.1mol•L-1的硫酸加水稀释成2L溶液,在此溶液中由水电离产生的H+ , 接近于( )A、1.0×10-4mol/L B、1.0×10-8mol/L C、1.0×10-10mol/L D、1.0×10-11mol/L17. 下列各组离子在相应的条件下可能大量共存的是( )A、能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ B、由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42- C、在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- D、Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+18. 25 ℃时有三瓶溶液:pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )A、中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积 B、往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全 C、将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-) D、25 ℃时pH=3的盐酸、pH=3的醋酸溶液中水电离出的c(H+)均为10-11 mol·L-119. 关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法错误的是( )A、c(NH+4):③>① B、水电离出的c(H+):②>① C、①和②等体积混合后的溶液:c(H+)=c(OH )+c(NH3·H2O) D、①和③等体积混合后的溶液:c(NH+4)>c(Cl )>c(OH )>c(H+)20. 已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )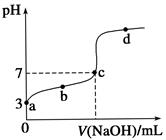 A、a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1 B、b点表示的溶液中c(CH3COO-)>c(Na+) C、c点表示CH3COOH和NaOH恰好反应完全 D、b、d点表示的溶液中 均等于K21. 在铁制品上镀上一层锌层,以下电镀方案中合理的是( )A、锌作阳极,铁制品作阴极,溶液中含Fe2+ B、锌作阴极,铁制品作阳极,溶液中含Zn2+ C、锌作阴极,铁制品作阳极,溶液中含Fe3+ D、锌作阳极,铁制品作阴极,溶液中含Zn2+22. 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断错误的是( )
A、a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1 B、b点表示的溶液中c(CH3COO-)>c(Na+) C、c点表示CH3COOH和NaOH恰好反应完全 D、b、d点表示的溶液中 均等于K21. 在铁制品上镀上一层锌层,以下电镀方案中合理的是( )A、锌作阳极,铁制品作阴极,溶液中含Fe2+ B、锌作阴极,铁制品作阳极,溶液中含Zn2+ C、锌作阴极,铁制品作阳极,溶液中含Fe3+ D、锌作阳极,铁制品作阴极,溶液中含Zn2+22. 铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断错误的是( )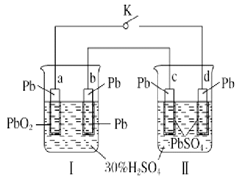 A、K闭合时,d极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- B、当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2mol C、K闭合时,Ⅱ中SO42-向c极迁移 D、K闭合一段时间后,Ⅱ可单独作为原电池,d极为正极23. 如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
A、K闭合时,d极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- B、当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2mol C、K闭合时,Ⅱ中SO42-向c极迁移 D、K闭合一段时间后,Ⅱ可单独作为原电池,d极为正极23. 如下图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )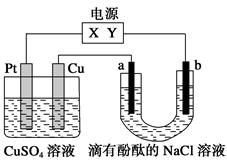 A、Pt为阴极,Cu为阳极 B、b极的电极反应式是2H++2e-=H2↑ C、电解过程中CuSO4溶液的pH逐渐增大 D、Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体24. 在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )A、 B、 C、 D、25. 有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )A、电池正极发生的反应:O2+4e-=2O2- B、电池负极发生的反应:CH4+4O2--8e-=CO2+2H2O C、固体电解质里的O2-的移动方向:由正极流向负极 D、向外电路释放电子的电极:正极(即电子由正极流向负极)
A、Pt为阴极,Cu为阳极 B、b极的电极反应式是2H++2e-=H2↑ C、电解过程中CuSO4溶液的pH逐渐增大 D、Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体24. 在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )A、 B、 C、 D、25. 有位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是用于制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。以下判断错误的是( )A、电池正极发生的反应:O2+4e-=2O2- B、电池负极发生的反应:CH4+4O2--8e-=CO2+2H2O C、固体电解质里的O2-的移动方向:由正极流向负极 D、向外电路释放电子的电极:正极(即电子由正极流向负极)二、填空题
-
26. 一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。(1)、一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质
A、B的转化率之比为1∶2 B、起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx) C、当2υ正(A)=υ逆(B)时,反应一定达到平衡状态 D、充入惰性气体(如Ar),平衡向正反应方向移动(2)、K和x的关系满足K=。在保证A浓度不变的情况下,扩大容器的体积,平衡(填字母)。A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)、该反应的逆反应速率与时间的关系如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时;t8时。
②t2时平衡向(填“正反应”或“逆反应”)方向移动。
27. 如图Ⅰ所示是用石墨和铁作电极电解饱和食盐水的装置,请填空: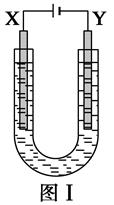 (1)、X的电极名称是极,发生的电极反应式为 , Y极的电极材料是 , 检验X极产物的方法是。(2)、某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是(填化学式),其形成原因是 , 该沉淀在空气中放置,现象是。
(1)、X的电极名称是极,发生的电极反应式为 , Y极的电极材料是 , 检验X极产物的方法是。(2)、某同学在实验时误将两种电极材料接反,导致X极上未收集到预期产物,一段时间后又将两极的连接方式纠正过来,发现X极附近出现了白色沉淀,此沉淀是(填化学式),其形成原因是 , 该沉淀在空气中放置,现象是。