2017年广东省中考化学模拟试卷(信息卷)(一)
试卷更新日期:2017-07-10 类型:中考模拟
一、单项选择题
-
1. 下列变化中,属于化学变化的是( )A、纸张燃烧 B、水结成冰 C、干冰升华 D、海水晒盐2. 下列图形中,可表示塑料包装制品回收标志的是( )A、
 B、
B、 C、
C、 D、
D、 3. 某化学反应中,各物质质量随时间变化的曲线如图所示. 其中说法一定正确的是( )
3. 某化学反应中,各物质质量随时间变化的曲线如图所示. 其中说法一定正确的是( ) A、该反应是分解反应 B、物质 c 发生还原反应 C、物质 a 中元素种类等于 b 和 c 中元素种类之和 D、物质 b 是化合物4. 党的十八大报告中提出建设“美丽中国”.下列做法不符合这一要求的是( )A、合理开发洁净能源 B、全面关停化工企业 C、改进汽车尾气净化技术 D、研发易降解的生物农药和塑料5. 下列受市民消费者依赖的无公害绿色食品中,富含维生素的是( )A、草莓 B、大米 C、鲤鱼 D、豆腐6. 生活离不开化学,下列认识错误的是( )A、氦气可用于填充安全气球 B、在管道煤气中添加微量难闻气味的气体是为了及时发现煤气泄漏 C、用洗涤剂除油污是因为洗涤剂能将油污溶解,形成溶液 D、用硬水洗涤衣物,既浪费肥皂也洗不净衣物7. 在奥运比赛中,举重运动员举重前常用白色的“镁粉”搓手,是因为“镁粉”质轻、吸水性好,可作防滑剂.“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)4 5MgO+X+4CO2↑,则X的化学式是( )A、O2 B、CO C、Mg(OH)2 D、H2O8. 下表对部分化学知识的归纳完全正确的一组是( )
A、该反应是分解反应 B、物质 c 发生还原反应 C、物质 a 中元素种类等于 b 和 c 中元素种类之和 D、物质 b 是化合物4. 党的十八大报告中提出建设“美丽中国”.下列做法不符合这一要求的是( )A、合理开发洁净能源 B、全面关停化工企业 C、改进汽车尾气净化技术 D、研发易降解的生物农药和塑料5. 下列受市民消费者依赖的无公害绿色食品中,富含维生素的是( )A、草莓 B、大米 C、鲤鱼 D、豆腐6. 生活离不开化学,下列认识错误的是( )A、氦气可用于填充安全气球 B、在管道煤气中添加微量难闻气味的气体是为了及时发现煤气泄漏 C、用洗涤剂除油污是因为洗涤剂能将油污溶解,形成溶液 D、用硬水洗涤衣物,既浪费肥皂也洗不净衣物7. 在奥运比赛中,举重运动员举重前常用白色的“镁粉”搓手,是因为“镁粉”质轻、吸水性好,可作防滑剂.“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)4 5MgO+X+4CO2↑,则X的化学式是( )A、O2 B、CO C、Mg(OH)2 D、H2O8. 下表对部分化学知识的归纳完全正确的一组是( )A
健康常识
人体缺铁元素会导致缺铁性贫血
碘元素是人体必需的常量元素
B
生活常识
热水瓶中的水垢可用食醋除去
肥皂水可区分硬水和软水
C
防治污染
废旧电池不必集中回收处理
工业“三废”处理达标后排放
D
安全常识
电器着火用水扑灭
进入深井前做灯火实验
A、A B、B C、C D、D9. 我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破.其成果在最近的美国《科学》杂志发表.该转化的微观示意图如图,有关转化的说法错误的是( ) A、催化剂改变了反应速率 B、生成物之一为 C2H4 C、反应前后原子的种类发生了变化 D、反应物与生成物均有分子构成10. 下列鉴别两种不同物质的方法中不正确的是( )
A、催化剂改变了反应速率 B、生成物之一为 C2H4 C、反应前后原子的种类发生了变化 D、反应物与生成物均有分子构成10. 下列鉴别两种不同物质的方法中不正确的是( )序号
待鉴别的物质
鉴别方法
A
氮气与二氧化碳
点燃的木条
B
氢氧化钠与硝酸铵
加水,测量溶液温度的变化
C
硬水和软水
加肥皂水
D
氧化铜与铁粉
用磁铁吸引
A、A B、B C、C D、D11. 逻辑推理是一种重要的化学思维方法,以下推理合理的是( )A、因为碱溶液能跟某些非金属氧化物反应,所以碱溶液能吸收 CO 气体 B、因为蜡烛燃烧生成 CO2和 H2O,所以蜡烛组成里一定含有 C 和 H C、因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 D、因为酸溶液呈酸性,所以呈酸性的溶液一定都是酸溶液12. 分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是(( )A、NaNO3NaCl H2SO4 B、CaCO3 NaOH Na2SO4 C、BaCl2NaNO3 CuSO4 D、AgNO3 Na2SO4 NaCl13. 下列对一些事实的解释中,不合理的是( )选项
事 实
解 释
A
盐酸、稀硫酸都能使紫色石蕊试液变红
它们所含的阳离子全部都是H+
B
活性炭用于防毒面具
活性炭具有吸附性
C
鱼、虾能在水中生存
氧气易溶于水
D
食盐是咸的,白糖是甜的
不同种物质的分子性质不同
A、A B、B C、C D、D14. 如图分别与相应的操作过程相对应,其中正确的是( ) A、向一接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化) B、向等质量、等溶质质量分数的稀硫酸中分别加入足量的镁片和锌片 C、向 pH=10 的氢氧化钙溶液中不断加水稀释 D、向含有硫酸的硫酸铜溶液中加入过量的氢氧化钠溶液
A、向一接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化) B、向等质量、等溶质质量分数的稀硫酸中分别加入足量的镁片和锌片 C、向 pH=10 的氢氧化钙溶液中不断加水稀释 D、向含有硫酸的硫酸铜溶液中加入过量的氢氧化钠溶液二、填空题
-
15. 回答下列问题:(1)、请用化学用语表示:3个钾原子 , 2个氮分子;(2)、如图是铝的结构示意图和在周期表中的位置图,则铝原子的核电荷数是 , 铝元素的相对原子质量是;
 (3)、物质①牛奶;②食醋;③蔗糖;④矿泉水,其中属于纯净物的是(填序号).16. 合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要.(1)、2013年12月广州建业大厦发生严重火灾.从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了 .(2)、高层建筑物通常设计了灭火用的洒水系统.从灭火原理分析,洒水的作用主要是 .(3)、分析下表中的数据,回答问题:
(3)、物质①牛奶;②食醋;③蔗糖;④矿泉水,其中属于纯净物的是(填序号).16. 合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要.(1)、2013年12月广州建业大厦发生严重火灾.从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了 .(2)、高层建筑物通常设计了灭火用的洒水系统.从灭火原理分析,洒水的作用主要是 .(3)、分析下表中的数据,回答问题:物质代号
L
M
N
P
熔点/℃
﹣117
3550
44
﹣259
沸点/℃
78
4827
257
﹣253
着火点/℃
510
370
40
580
①有人认为“物质的熔、沸点越高,着火点越高”,该结论(填“合理”或“不合理”).
②已知酒精灯火焰的温度约为500℃.利用如图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是(填代号).
 17. 已知镉(Cd)的金属活动性与铁、锌相近,镉元素在化合物中常显+2价.(1)、将镉丝插入下列溶液能发生反应的化学方程式是
17. 已知镉(Cd)的金属活动性与铁、锌相近,镉元素在化合物中常显+2价.(1)、将镉丝插入下列溶液能发生反应的化学方程式是①NaCl溶液 ②乙醇溶液 ③AgNO3溶液 ④KOH溶液
(2)、镍镉电池应用广泛,为了防止污染环境,将废旧镍镉电池中回收镉的一种方法如下:步骤1:将废旧电池破碎成细颗粒后培烧,将镉转化为氧化镉;
步骤2:将含氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和一氧化碳.步骤2中氧化镉变成镉的化学方程式是 .
18. 根据溶解度受温度影响的信息和溶解度曲线(如图1)回答下列问题:已知硝酸钾的溶解度受温度影响比较大,食盐的溶解度受温度影响较小,熟石灰的溶解度随温度升高而减少. (1)、A是的溶解度曲线.(2)、50℃时,硝酸钾的溶解度(大于小于或等于)氯化钠的溶解度.(3)、欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 .(4)、如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是(填序号).
(1)、A是的溶解度曲线.(2)、50℃时,硝酸钾的溶解度(大于小于或等于)氯化钠的溶解度.(3)、欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是 .(4)、如图2所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是(填序号).A.反应放热,温度升高,氢氧化钙溶解度降低
B.反应消耗水,氢氧化钙析出
C.生石灰与水反应生成的氢氧化钙不再溶解.
19. 以化合价为纵坐标,以物质的类别为横坐标所绘制的图象叫价类图.如图为铁的价类图,例如E点可表示为+2价的亚铁盐,请回答: (1)、A点表示的物质所属的物质类别是 .(2)、请写出B点表示的物质化学式 .(3)、已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式 .
(1)、A点表示的物质所属的物质类别是 .(2)、请写出B点表示的物质化学式 .(3)、已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式 .三、综合题
-
20. 如图是初中化学常见物质之间的转化关系,A 是一种常用的食品干燥剂,E、F 均为氧化物,B、C、D 三种物质分别是酸、碱、盐中的一种,其中有一种是胃液的主要成分(“﹣”表示相互反应,“→”表示相互转化. 部分反应的反
应物、生成物和反应条件未标出). 请回答:
 (1)、A、C、D 的化学式是、、 .(2)、B 和 D 反应的化学方程式为 , 该反应属于基本反应类型中的反应.(3)、若 F 为黑色固体,写出 F 转化为 E 的化学方程式: .21. 黄铜矿(主要成分 CuFeS2)经初步处理后,所得溶液中的溶质为Fe2(SO4)3、CuSO4及 H2SO4 . 某同学通过废铁屑与所得溶液反应,制取还原铁粉并回收铜. 主要步骤如图所示:
(1)、A、C、D 的化学式是、、 .(2)、B 和 D 反应的化学方程式为 , 该反应属于基本反应类型中的反应.(3)、若 F 为黑色固体,写出 F 转化为 E 的化学方程式: .21. 黄铜矿(主要成分 CuFeS2)经初步处理后,所得溶液中的溶质为Fe2(SO4)3、CuSO4及 H2SO4 . 某同学通过废铁屑与所得溶液反应,制取还原铁粉并回收铜. 主要步骤如图所示: (1)、Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4 , 其中 x、y、z 为化学计量数,z 的值为 .(2)、操作Ⅰ的名称是 , 此操作中起到引流作用的仪器是 .(3)、步骤Ⅰ中,生成铜的化学方程式: .(4)、步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .(5)、步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是(填化学式).(6)、隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3 FeO Fe,
(1)、Fe2(SO4)3与铁反应的化学方程式:x Fe2(SO4)3+y Fe═z FeSO4 , 其中 x、y、z 为化学计量数,z 的值为 .(2)、操作Ⅰ的名称是 , 此操作中起到引流作用的仪器是 .(3)、步骤Ⅰ中,生成铜的化学方程式: .(4)、步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是 .(5)、步骤Ⅱ中加入一种可溶性试剂可实现其转化,从复分解反应发生的条件分析,该试剂可以是(填化学式).(6)、隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3 FeO Fe,实际作还原剂的是 CO. 写出“焙烧”过程中各步反应的化学方程式:
①FeCO3 FeO+CO2↑
② .
四、实验题
-
22. 某校化学研究性学习小组探究气体制取的实验原理与方法.(1)、甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体
所需要品
装置连接顺序
反应化学方程式
干燥的二氧化碳
大理石和稀盐酸
(2)、乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开 K1、关闭 K2 时,利用 I、Ⅱ装置可直接进行的实验是(填序号).
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)、丙同学认为在不改变 I、Ⅱ、Ⅲ装置的仪器及位置的前提下,该装置可用于过氧化钠(Na2O2)固体与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为;她的改进措施是 .
(4)、丁同学打开 K2、关闭 K1 , 利用 I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时 C 中盛放的物质是 , 可以观察到的现象是 .(5)、对用氯酸钾和二氧化锰的混合物制取 O2后的固体残渣(假定已完全反应)作如下回收处理:①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是(填写选项序号a. 烘干b. 溶解c.过滤d.洗涤
②用所得氯化钾晶体配制 50g 质量分数为 5%的氯化钾溶液,需要氯化钾的质量为 g
③过滤、蒸发时都需用到的仪器是(填序号).
A. 酒精灯B. 烧杯C. 玻璃棒D.漏斗E.量筒
(6)、小明用 6.5g 可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成 0.2g 氢气,则此锌粉中一定含有的金属杂质是 .23. 实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),为确认其中的溶质,同学们进行了如下的探究活动.请你参与到其中去,回答有关问题.
【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想 IV:该溶液的溶质是NaHCO3 .
【查阅资料】常温下物质的相关信息如表:
物质
NaCl
NaOH
Na2CO3
NaHCO3
常温下的溶解度/g
36
109
21.5
9.6
常温下稀溶液的pH
7
13
11
9
(1)、从物质的相关信息可知,该溶液的溶质不是NaHCO3 , 因为常温下NaHCO3溶液溶质的质量分数最大是(精确到01.%).【进行实验】测定溶液的pH大于7,该溶液的溶质不是(填化学式).
(2)、同学们又进行了如下实验,实验过程如图: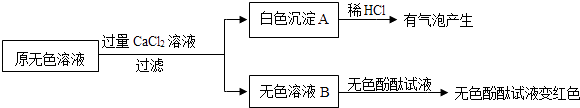
产生白色沉淀的化学方程式是 .
实验可以判断原无色溶液中含有的溶质有 .
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质.
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 , 然后过滤.反应化学方程式是 .
五、计算题
-
24. 乙硫醇是 2016 年版吉尼斯世界纪录中收录的最臭的物质. 空气中仅含五百亿分之一的乙硫醇时,其臭味就可嗅到,通常被加入液化煤气中做臭味指示剂. 乙硫醇的结构式见图,请回答下列问题:
 (1)、写出乙硫醇的化学式;(2)、乙硫醇的相对分子质量为;(3)、乙硫醇中碳、氢、硫原子个数比是;(4)、乙硫醇中硫元素的质量分数为(精确到 0.1%).25. 化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法,请回答有关问题:(1)、甲同学:取50g废水于烧杯中,逐渐滴入溶质质量分数为20%的NaOH溶液,反应过程溶液pH变化如图.
(1)、写出乙硫醇的化学式;(2)、乙硫醇的相对分子质量为;(3)、乙硫醇中碳、氢、硫原子个数比是;(4)、乙硫醇中硫元素的质量分数为(精确到 0.1%).25. 化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法,请回答有关问题:(1)、甲同学:取50g废水于烧杯中,逐渐滴入溶质质量分数为20%的NaOH溶液,反应过程溶液pH变化如图.
①50g废水中H2SO4的质量是多少?写出计算过程 .
②当加入30g NaOH溶液时,烧杯中的溶质为(填化学式).
(2)、乙同学:改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量,结果可能会(填“偏高”、“偏低”、“不变”),理由是 .