2017年江苏省苏州市中考化学试卷
试卷更新日期:2017-07-06 类型:中考真卷
一、单项选择题
-
1. 2017年“世界环境日”中国确定的主题是“绿水青山就是金山银山”.下列做法与之相违背的是( )A、利用风力发电 B、增加绿化面积 C、节约用水用电 D、直接排放废气2. 下列元素名称与元素符号书写都正确的是( )A、锌Zn B、硅SI C、氯cl D、贡Hg3. 下列化学仪器对应的名称书写正确的是( )A、
 长劲漏斗
B、
长劲漏斗
B、 量桶
C、
量桶
C、 坩埚钳
D、
坩埚钳
D、 椎形瓶
4. 下列变化属于化学变化的是( )A、滴水成冰 B、蜡烛燃烧 C、汽油挥发 D、铜丝折弯5. 下列物质属于纯净物的是( )A、盐水 B、石油 C、生铁 D、氢气6. 下列反应属于置换反应的是( )A、2CO+O2 2CO2 B、H2CO3 H2O+CO2↑ C、NaOH+HCl═NaCl+H2O D、2Al+6HCl═2AlCl3+3H2↑7. 下列关于空气的说法中,不正确的是( )A、工业上采用分离液态空气法获得氧气 B、二氧化硫是空气污染物之一 C、空气中氧气质量占空气质量的21% D、空气中的氧气来源于绿色植物的光合作用8. 下列实验操作图示不正确的是( )A、
椎形瓶
4. 下列变化属于化学变化的是( )A、滴水成冰 B、蜡烛燃烧 C、汽油挥发 D、铜丝折弯5. 下列物质属于纯净物的是( )A、盐水 B、石油 C、生铁 D、氢气6. 下列反应属于置换反应的是( )A、2CO+O2 2CO2 B、H2CO3 H2O+CO2↑ C、NaOH+HCl═NaCl+H2O D、2Al+6HCl═2AlCl3+3H2↑7. 下列关于空气的说法中,不正确的是( )A、工业上采用分离液态空气法获得氧气 B、二氧化硫是空气污染物之一 C、空气中氧气质量占空气质量的21% D、空气中的氧气来源于绿色植物的光合作用8. 下列实验操作图示不正确的是( )A、 过滤悬浊液
B、
过滤悬浊液
B、 加热液体
C、
加热液体
C、 蒸发溶液
D、
蒸发溶液
D、 倾倒液体
9. 下列有关水的说法中,不正确的是( )A、水是一种常用的溶剂 B、保护水资源是全人类的责任 C、常用肥皂水来鉴别硬水和软水 D、电解水得到的氧气和氢气的体积比为2:110. 下列物质由离子构成的是( )A、二氧化碳 B、氯化钠 C、铁 D、水11. 下列关于氧气的说法中,不正确的是( )A、氧气能支持燃烧,所以氧气可作燃料 B、氧气能使带火星的木条复燃 C、红磷在氧气中燃烧,产生浓厚的白烟 D、实验室加热高锰酸钾制取氧气时,试管内靠近导管处放一团蓬松的棉花12. 下列有关分子的说法中,不正确的是( )A、分子的质量和体积都很小 B、温度升高,分子的体积变大 C、分子在不停她运动 D、温度越高,分子运动速率越快13. 下列有关化学用语表示不正确的是( )A、2个铝离子:2Al3+ B、钠原子的结构示意图:
倾倒液体
9. 下列有关水的说法中,不正确的是( )A、水是一种常用的溶剂 B、保护水资源是全人类的责任 C、常用肥皂水来鉴别硬水和软水 D、电解水得到的氧气和氢气的体积比为2:110. 下列物质由离子构成的是( )A、二氧化碳 B、氯化钠 C、铁 D、水11. 下列关于氧气的说法中,不正确的是( )A、氧气能支持燃烧,所以氧气可作燃料 B、氧气能使带火星的木条复燃 C、红磷在氧气中燃烧,产生浓厚的白烟 D、实验室加热高锰酸钾制取氧气时,试管内靠近导管处放一团蓬松的棉花12. 下列有关分子的说法中,不正确的是( )A、分子的质量和体积都很小 B、温度升高,分子的体积变大 C、分子在不停她运动 D、温度越高,分子运动速率越快13. 下列有关化学用语表示不正确的是( )A、2个铝离子:2Al3+ B、钠原子的结构示意图: C、氧分子:O
D、氧化镁中镁元素显+2价:
14. 下列关于金属的说法中,不正确的是( )A、铜有良好的导电性,常用于制作导线 B、所有的金属都能与稀盐酸反应 C、铁制品在干燥的空气中不易生锈 D、不锈钢具有较强的耐腐蚀性,可用于制作医疗器械15. 下列材料属于有机合成材料的是( )A、陶瓷 B、硬铝 C、塑料 D、钢筋混凝土16. 下列关于溶液的说法中,正确的是( )A、泥土加入水中,振荡后可以形成溶液 B、蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度 C、氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子 D、氯化钠饱和溶液中不能再溶解少量硝酸钾晶体17. 下列叙述正确的是( )A、用小苏打治疗胃酸过多 B、用氢氧化钠改良酸性土壤 C、用铁桶长时间存放硫酸铜溶液 D、用食盐水除去热水瓶中的水垢18. 苏州盛产杨梅.杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6 . 下列有关叶酸的说法中正确的是( )A、叶酸的相对分子质量为441 g B、叶酸中氮元素的质量分数大于氧元素的质量分数 C、叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6 D、叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成19. 下列说法中不正确的是( )A、大米主要成分是淀粉,淀粉遇碘化钾溶液变蓝色 B、鸡蛋清中加入饱和硫酸铵溶液,有白色沉淀 C、油脂不溶于水,易溶于汽油等有机溶剂 D、新鲜蔬菜、水果中含有丰富的维生素C20. 下列各组离子在水溶液中能大量共存的是( )A、Cu2+、Na+、NO3﹣、OH﹣ B、H+、K+、CO32﹣、Cl﹣ C、Mg2+、NH4+、OH﹣、SO42﹣ D、Na+、Ca2+、NO3﹣、Cl﹣21. 氯化钠和硝酸钾两种固体的溶解度曲线如图所示.下列说法正确的是( )
C、氧分子:O
D、氧化镁中镁元素显+2价:
14. 下列关于金属的说法中,不正确的是( )A、铜有良好的导电性,常用于制作导线 B、所有的金属都能与稀盐酸反应 C、铁制品在干燥的空气中不易生锈 D、不锈钢具有较强的耐腐蚀性,可用于制作医疗器械15. 下列材料属于有机合成材料的是( )A、陶瓷 B、硬铝 C、塑料 D、钢筋混凝土16. 下列关于溶液的说法中,正确的是( )A、泥土加入水中,振荡后可以形成溶液 B、蔗糖溶液上半部分溶液的甜度低于下半部分溶液的甜度 C、氢氧化钠溶液能导电,因为溶液中有较多自由移动的离子 D、氯化钠饱和溶液中不能再溶解少量硝酸钾晶体17. 下列叙述正确的是( )A、用小苏打治疗胃酸过多 B、用氢氧化钠改良酸性土壤 C、用铁桶长时间存放硫酸铜溶液 D、用食盐水除去热水瓶中的水垢18. 苏州盛产杨梅.杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6 . 下列有关叶酸的说法中正确的是( )A、叶酸的相对分子质量为441 g B、叶酸中氮元素的质量分数大于氧元素的质量分数 C、叶酸中碳、氢、氮、氧四种元素质量比为19:19:7:6 D、叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成19. 下列说法中不正确的是( )A、大米主要成分是淀粉,淀粉遇碘化钾溶液变蓝色 B、鸡蛋清中加入饱和硫酸铵溶液,有白色沉淀 C、油脂不溶于水,易溶于汽油等有机溶剂 D、新鲜蔬菜、水果中含有丰富的维生素C20. 下列各组离子在水溶液中能大量共存的是( )A、Cu2+、Na+、NO3﹣、OH﹣ B、H+、K+、CO32﹣、Cl﹣ C、Mg2+、NH4+、OH﹣、SO42﹣ D、Na+、Ca2+、NO3﹣、Cl﹣21. 氯化钠和硝酸钾两种固体的溶解度曲线如图所示.下列说法正确的是( )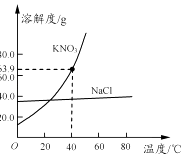 A、硝酸钾的溶解度大于氯化钠的溶解度 B、常用冷却结晶的方法从氯化钠溶液中获得其晶体 C、40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0% D、将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)22. 鉴别下列各组物质,不能达到目的是( )A、黄铜片和纯铜片:相互刻划比较硬度 B、棉线和羊毛线:灼烧后闻气味 C、硫酸铵固体和氯化铵固体:加熟石灰混合研磨后闻气味 D、氢氧化钠固体和硝酸铵固体:加水溶解后测温度23. 下列有关实验现象的描述中,正确的是( )A、加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴 B、细铁丝在氧气中燃烧,火星四射,生成红棕色固体 C、镁条在空气中燃烧,产生黑烟,生成黑色粉末 D、向少量氧化铜中加入稀硫酸,有气泡产生,黑色粉末逐渐消失,溶液变蓝24. 除去下列物质中的少量杂质(括号内为杂质),所选试剂正确的是( )A、CaCO3粉末(CaCl2粉末)﹣﹣水 B、CaO粉末[Ca(OH)2粉末]﹣﹣水 C、KCl溶液(KOH)﹣﹣稀硝酸 D、NaOH溶液(Na2CO3)﹣﹣稀盐酸25. 甲、乙、丙三种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已略去).下列选项不能实现图示转化的是( )
A、硝酸钾的溶解度大于氯化钠的溶解度 B、常用冷却结晶的方法从氯化钠溶液中获得其晶体 C、40℃时,将35 g硝酸钾晶体放入50 g水中,充分搅拌后,所得溶液的溶质质量分数为39.0% D、将20℃的硝酸钾饱和溶液升温至60℃,溶液的溶质质量分数增大(忽略水分蒸发)22. 鉴别下列各组物质,不能达到目的是( )A、黄铜片和纯铜片:相互刻划比较硬度 B、棉线和羊毛线:灼烧后闻气味 C、硫酸铵固体和氯化铵固体:加熟石灰混合研磨后闻气味 D、氢氧化钠固体和硝酸铵固体:加水溶解后测温度23. 下列有关实验现象的描述中,正确的是( )A、加热试管内的碱式碳酸铜,绿色粉末逐渐变黑,试管口有小水滴 B、细铁丝在氧气中燃烧,火星四射,生成红棕色固体 C、镁条在空气中燃烧,产生黑烟,生成黑色粉末 D、向少量氧化铜中加入稀硫酸,有气泡产生,黑色粉末逐渐消失,溶液变蓝24. 除去下列物质中的少量杂质(括号内为杂质),所选试剂正确的是( )A、CaCO3粉末(CaCl2粉末)﹣﹣水 B、CaO粉末[Ca(OH)2粉末]﹣﹣水 C、KCl溶液(KOH)﹣﹣稀硝酸 D、NaOH溶液(Na2CO3)﹣﹣稀盐酸25. 甲、乙、丙三种物质的转化关系如图所示(“→”表示反应一步实现,部分物质和反应条件已略去).下列选项不能实现图示转化的是( )选项
甲
乙
丙
A
H2SO4
H2
H2O
B
C
CO
CO2
C
Ca(OH)2
CaCl2
CaCO3
D
NaOH
NaCl
NaNO3
 A、A B、B C、C D、D
A、A B、B C、C D、D二、非选择题
-
26. 请用线段连接有对应关系的相邻两行间的点(每个点只能连接1次).
物质的类别:单质氧化物酸碱盐
A. B. C. D. E.AgCl
27. 化学与人类生活、生产息息相关.请回答下列问题:(1)、可燃冰的主要成分是甲烷水合物,燃烧时化学能转化为 能.(2)、用灯帽盖灭酒精灯火焰的原理是 .(3)、用洗洁精除去餐具上的油污是因为洗洁精在水中对油污具有 作用.(4)、家庭用净水器利用活性炭的 ,除去有色有味的杂质.(5)、人体缺钙易患的疾病是 (用序号填写).①骨质疏松 ②贫血.
28. 根据下列反应事实写出相应的化学方程式.(1)、双氧水在二氧化锰的催化作用下生成水和氧气:(2)、在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫(SO3): .(3)、Cu和AgNO3溶液反应,生成Cu(NO3)2溶液和Ag: .(4)、少量CuSO4溶液滴入NaOH稀溶液中生成Cu(OH)2沉淀和Na2SO4溶液: .(5)、一氧化碳和四氧化三铁(Fe3O4)杠高温下反应,生成铁和二氧化碳: .29. 实验室常用块状大理石和稀盐酸制取CO2气体.(1)、写出实验室制取CO2的化学方裎式: .(2)、若用下图所示装置(固定装置省略)制CO2:

连接好装置后,需检查装置的气密性.具体操作方法是:先 (填字母,下同),后 若导管口有气泡,放手后导管内上升一段稳定的水柱,则气密性良好.
A.用手捂住试管 B.将导管一端浸入水中
(3)、实验窒收集CO2可用的方法是 (填字母).A、排水法 B、向下排空气法 C、向上排空气法(4)、实验室常用澄清石灰水检验CO2 , 写出反应的化学方程式: .(5)、某些大理石中含少量硫化物,使制得的CO2中混有H2S气体.欲获取纯净、干燥的CO2 , 需对发生装置中产生的气体进行除杂,实验装置如下:

查阅资料:I.H2S能与NaOH等碱溶液、CuSO4溶液反应.
Ⅱ.CO2中混有的HCl气体可用饱和NaHCO3溶液吸收.
①装置甲中所盛试剂应选用 (填字母).
A.浓硫酸 B.NaOH溶液 C.澄清石灰水 D.CuSO4溶液
②装置丙的作用是 .
30. 某工厂产生的烧渣(主要含FeO、Fe2O3 , 还有一定量的SiO2)可用于制备七水合硫酸亚铁晶体(FeSO4•7H2O),其工艺流程如下:
查阅资料:SiO2不溶于水,也不与稀硫酸反应.
(1)、“浸取”步骤中,FeO、Fe2O3和稀硫酸发生反应的化学方程式分别为FeO+H2SO4=FeSO4+H2O、 .
(2)、为提高“浸取”步骤的反应速率,可采取的具体措施有 (写2条,不考虑“搅拌”和“使用催化剂”).(3)、“还原”步骤的目的是将Fe3+转化为Fe2+ , 试剂X可用SO2或Fe.①若试剂X是SO2 , 转化原理为SO2+Fe2 (SO4)3+2Y═2FeSO4+2H2SO4 , 则Y的化学式是 .
②若试剂X是Fe,转化原理为Fe+Fe2(SO4)3=3FeSO4 . 测得“还原”后溶液的pH明显增大,其原因是 .
31. 为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验.(提示:本实验所用汽油与KMnO4、碘均不发生化学反应)(1)、【实验1】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象.
实验步骤
实验操作图示
实验操作及现象
步骤1

振荡后静置:
①A试管中晶体全部溶解,溶液呈 色;B试管中晶体不溶解,汽油不变色.
步骤2

将步骤1中A试管内溶液倒入B试管中,振荡后静置:②B试管中观察到的现象为 .
(2)、【实验2】碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题.
实验操作图示
实验结论或解释

③由图2所示现象可知:碘 (选填“不”、“微”或“易”)溶于水
④图3所示试管中液体分层.上层紫红色溶液的名称是 .说明碘在汽油中的溶解性比在水中 (选填“强”或“弱”)
(3)、【反思与应用】①碘易溶于酒精.若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体 (选填“分层”或“小分层”).
②“从稀碘水中提取碘”是“海带提碘”工艺中的一个重要步骤,其原理类似【实验2】中第二步操作.工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是 .
32. 实验室常会产生含硫酸的废水,需经处理至中性.某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水.(1)、定性检测废水检测废水呈酸性的方法是 .
(2)、配制200g质量分数为5.6%的氢氧化钾溶液①计算
m(KOH)= g,V(H2O) mL(水的密度近似为1.0g•mL﹣1).
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量.然后 (按操作先后顺序,填字母),直至天平平衡.
A .向烧杯中加氢氧化钾固体 B .按需要添加砝码、移动游码
C .量取; D .溶解 E .转移.
(3)、定量测定废水取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示.(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)

①P点对应溶液中一定存在的阳离子有 (填离子符号).
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%).
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.1%).