2016-2017学年河北省邯郸市四县联考高二下学期期中化学试卷
试卷更新日期:2017-07-03 类型:期中考试
一、一.选择题
-
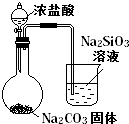
1. 化学与生活息息相关,下列说法正确的是( )A、医用酒精的浓度通常是95% B、淀粉、油脂和蛋白质都是高分子化合物 C、自行车钢架生锈通常是电化学腐蚀所致 D、煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化2. 下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )A、向水中加入少量的CH3COONa B、向水中加入少量的NaHSO4 C、向水中加入NaI并加热至100℃,pH=6 D、向水中加少量的KAl(SO4)23. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,18gD2O中所含的质子数为10NA B、标准状况下,11.2LO2参加反应转移的电子数一定为2NA C、28gN2和CO的混合气体中含有的分子数为NA D、5.6g铁与足量稀硫酸反应失去电子数为0.3NA4. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、pH=1的溶液中:Na+、Cu2+、Cl﹣、CO32﹣ B、0.1 mol•L﹣1 AlCl3溶液中:Cu2+、Mg2+、SO42﹣、NO3﹣ C、由水电离产生的c(H+)=10﹣12 mol•L﹣1的溶液中:NH4+、SO42﹣、HCO3﹣、Cl﹣ D、1.0mol/LKNO3溶液中:Fe2+、H+、Cl﹣、SO42﹣5. 下列有关说法中不正确的是( )A、将SO2通入BaCl2溶液中至饱和,无沉淀产生,再通入过量NH3 , 产生沉淀 B、二氧化硫可广泛用于食品的增白 C、用AlCl3溶液制取Al(OH)3 , 沉淀剂选用氨水比选用NaOH溶液好 D、纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,反应速率加快6. 下列离子方程式表达正确的是( )A、Na2S的水解:S2ˉ+2H2O⇌H2S+2OHˉ B、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ C、硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O D、向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO7. 下列叙述正确的是( )A、常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 B、常温下,将pH=10的氨水稀释后,溶液中所有离子浓度都减小 C、常温下,0.1 mol/L Na2S溶液中存在:c(OH﹣)=c(H+)+c(HS﹣)+c(H2S) D、常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A﹣)>c(OH﹣)=c(H+)8. 下列有关电解质溶液的说法正确的是( )A、向0.1mol•L﹣1 CH3COOH溶液中加入少量水,溶液中 减小 B、将CH3COONa溶液从20℃升温至30℃,溶液中 增大 C、向盐酸中加入氨水至中性,溶液中 >1 D、向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 不变9. 下列有关化学用语表示正确的是( )A、乙烯的结构简式为C2H4 B、质子数为53,中子数为78的碘原子:53131I C、S2﹣的结构示意图:
 D、NH4Cl的电子式为
D、NH4Cl的电子式为 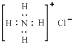 10. 下列图示与对应的叙述不相符合的是( )
10. 下列图示与对应的叙述不相符合的是( )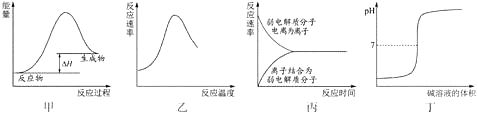 A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线11. 下列物质与其用途完全符合的是( )
A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线11. 下列物质与其用途完全符合的是( )①Na2O2﹣供氧剂 ②晶体Si﹣太阳能电池 ③AgI﹣人工降雨 ④NaCl﹣制纯碱 ⑤Al2O3﹣焊接钢轨 ⑥NaClO﹣消毒剂⑦Fe2O3﹣红色油漆或涂料 ⑧SO2﹣食品漂白剂 ⑨NH3﹣制冷剂.
A、①④⑤⑧⑨ B、①②③⑥⑦⑨ C、①②③④⑥⑦⑨ D、①②③④⑤⑥⑦⑧⑨12. 在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是( )A、反应物的浓度 B、反应物的转化率 C、正、逆反应速率 D、体系的压强13. 下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )强电解质
弱电解质
酸性氧化物
碱性氧化物
A
H2SO4
CH3COOH
NO2
Na2O
B
BaSO4
HClO
Mn2O7
CaO
C
NaCl
氨水
SO2
MnO2
D
HI
HF
CO2
Fe3O4
A、A B、B C、C D、D14. 下列物质间的转化在给定条件下能实现的是( )①NH3 NO2 HNO3
②SiO2 Na2SiO3 H2SiO3
③Mg(OH)2 MgCl2(aq) Mg
④Na Na2O2 Na2CO3 .
A、②④ B、③④ C、①④ D、①②③15. 糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述中,不正确的是( )A、植物油能使溴的四氯化碳溶液褪色 B、淀粉水解的最终产物是葡萄糖 C、葡萄糖能发生水解反应 D、蛋白质遇硫酸铜溶液后会变性16. 莽草酸结构简式如图.下列说法错误的是( )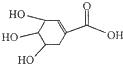 A、该物质分子式为C7H10O5 B、该物质与乙酸互为同系物 C、该物质能与乙醇发生酯化反应 D、1mol该物质与Na反应时,最多消耗Na 4mol17. 下列关于原子结构、元素性质的说法正确的是( )A、非金属元素组成的化合物中只含共价键 B、ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 C、同种元素的原子均有相同的质子数和中子数 D、IA族金属元素是同周期中金属性最强的元素18. 1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确的是( )A、该浓硝酸中HNO3的物质的量浓度是14.0mol/L B、加入NaOH溶液的体积是50mL C、浓硝酸在与合金反应中起了酸性和氧化性的双重作用 D、得到的金属氢氧化物的沉淀为3.12克19. 下列各装置图的叙述中,错误的是( )
A、该物质分子式为C7H10O5 B、该物质与乙酸互为同系物 C、该物质能与乙醇发生酯化反应 D、1mol该物质与Na反应时,最多消耗Na 4mol17. 下列关于原子结构、元素性质的说法正确的是( )A、非金属元素组成的化合物中只含共价键 B、ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 C、同种元素的原子均有相同的质子数和中子数 D、IA族金属元素是同周期中金属性最强的元素18. 1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确的是( )A、该浓硝酸中HNO3的物质的量浓度是14.0mol/L B、加入NaOH溶液的体积是50mL C、浓硝酸在与合金反应中起了酸性和氧化性的双重作用 D、得到的金属氢氧化物的沉淀为3.12克19. 下列各装置图的叙述中,错误的是( )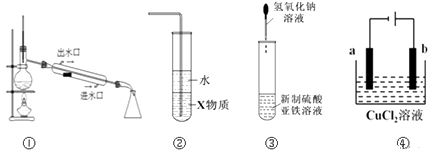 A、实验室用装置①蒸馏石油 B、装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 C、装置③可用于制备氢氧化亚铁并观察其颜色 D、装置④是电解精炼铜,b极为粗铜,发生氧化反应20. 对下列药品或事故的处理正确的是( )A、金属钠着火燃烧时用砂子灭火 B、氯水保存在无色透明的试剂瓶中 C、漂白粉保存在烧杯中 D、大量氯气泄漏时用氢氧化钠溶液浸湿的软布蒙面并迅速离开现场21. 碱性电池有容量大,放电电流大的特点,被广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3 . 下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为2MnO2+H2O+2e﹣═Mn2O3+2OH﹣ C、外电路中每通过0.2mol电子,锌的质量理论上减少13g D、电池工作时,电子由负极通过外电路流向正极22. 下列图中的实验方案,能达到实验目的是( )
A、实验室用装置①蒸馏石油 B、装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 C、装置③可用于制备氢氧化亚铁并观察其颜色 D、装置④是电解精炼铜,b极为粗铜,发生氧化反应20. 对下列药品或事故的处理正确的是( )A、金属钠着火燃烧时用砂子灭火 B、氯水保存在无色透明的试剂瓶中 C、漂白粉保存在烧杯中 D、大量氯气泄漏时用氢氧化钠溶液浸湿的软布蒙面并迅速离开现场21. 碱性电池有容量大,放电电流大的特点,被广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3 . 下列说法错误的是( )A、电池工作时,锌失去电子 B、电池正极的电极反应式为2MnO2+H2O+2e﹣═Mn2O3+2OH﹣ C、外电路中每通过0.2mol电子,锌的质量理论上减少13g D、电池工作时,电子由负极通过外电路流向正极22. 下列图中的实验方案,能达到实验目的是( )A
B
C
D
实验方案
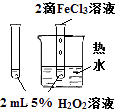
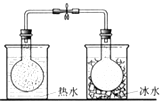
将NO2球浸泡在冰水和热水中
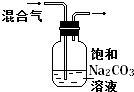
实验
目的
验证FeCl3对H2O2分解反应有催化作用
探究温度对平衡
2NO2⇌N2O4的影响
除去CO2气体中混有的SO2
比较HCl、H2CO3和H2SiO3的酸性强弱
A、A B、B C、C D、D二、二.填空题
-
23. 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol﹣1)的变化.
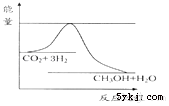 (1)、关于该反应的下列说法中,其△H0.(填“大于”、“小于”或“等于”),且在(填“较高”或“较低”)温度下有利于该反应自发进行.(2)、该反应平衡常数K的表达式为(3)、温度降低,平衡常数K(填“增大”、“不变”或“减小”).(4)、若为两个容积相同的密闭容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )(填“大于”“小于”或“等于”)乙容器内n(CH3OH )(5)、以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池.
(1)、关于该反应的下列说法中,其△H0.(填“大于”、“小于”或“等于”),且在(填“较高”或“较低”)温度下有利于该反应自发进行.(2)、该反应平衡常数K的表达式为(3)、温度降低,平衡常数K(填“增大”、“不变”或“减小”).(4)、若为两个容积相同的密闭容器,现向甲容器中充入1mol CO2(g)和3molH2(g),乙容器中充入1molCH3OH(g)和1molH2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH )(填“大于”“小于”或“等于”)乙容器内n(CH3OH )(5)、以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池.①负极的电极反应式
②若以石墨为电极,电解硫酸铜溶液,写出电解的化学反应方程式 .
24. 某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如图: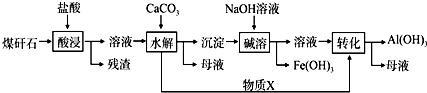 (1)、“酸浸”过程中主要反应的离子方程式为:、 .(2)、“酸浸”时,提高浸出速率的具体措施有、 . (写出两个)(3)、“碱溶”的目的是 . 物质X的电子式为 . 该工艺设计中,过量X参与反应的离子方程式是: .(4)、从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为: .25. 氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2 .
(1)、“酸浸”过程中主要反应的离子方程式为:、 .(2)、“酸浸”时,提高浸出速率的具体措施有、 . (写出两个)(3)、“碱溶”的目的是 . 物质X的电子式为 . 该工艺设计中,过量X参与反应的离子方程式是: .(4)、从流程中分离出来的Fe(OH)3沉淀可在碱性条件下用KClO溶液处理,制备新型水处理剂高铁酸钾(K2FeO4),该反应的离子方程式为: .25. 氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2 .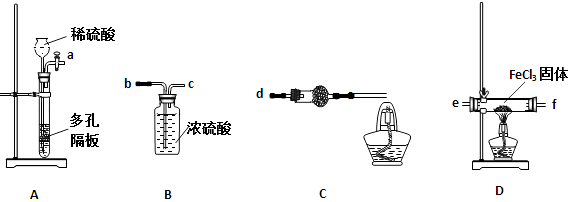 (1)、实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:(2)、气流从左至右,装置接口连接顺序是a(3)、装置C中干燥管中所盛试剂的名称是: , 作用是:(4)、装置D中发生的化学方程式是:(5)、为了测定氯化亚铁的质量分数,某同学进行了如下实验:
(1)、实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:(2)、气流从左至右,装置接口连接顺序是a(3)、装置C中干燥管中所盛试剂的名称是: , 作用是:(4)、装置D中发生的化学方程式是:(5)、为了测定氯化亚铁的质量分数,某同学进行了如下实验:称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L﹣1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl﹣)滴定结果如表所示:
滴定次数
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
1.04
25.03
2
1.98
25.99
3
3.20
25.24
①写出滴定过程中所发生的2个离子方程式 ,
②样品中氯化亚铁的质量分数为 .
三、选做题
-
26. 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.(1)、写出基态F原子的价电子排布式(2)、A、B、C三种元素第一电离能由大到小顺序为(用元素符号表示)(3)、A、C两元素形成的化合物AC2的分子空间构型 , AC2中心原子的杂化方式 , 与 AC2互为等电子体的粒子的化学式 , (分子和离子各写一种).(4)、D、E形成的一种离子化合物,在如图晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为n cm,阿伏加德罗常数为NA , 求晶胞的密度ρ=g/cm3(用含a、NA的计算式表示).

四、[化学--选修5:有机化学基础]
-
27. 有机物F是有机合成工业中一种重要的中间体.以甲苯和丙烯为起始原料合成F的工艺流程如图:
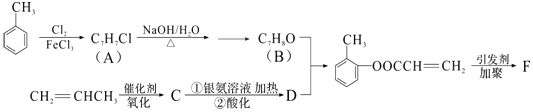
回答下列问题:
(1)、化合物B中含氧官能团名称是 F的结构简式(2)、写出C与银氨溶液共热的化学反应方程式:(3)、化合物D不能发生的反应有(填序号).①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)、B的含苯环结构的同分异构体还有种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是(填结构简式).(5)、B与D发生反应的类型 .
-