2017年江苏省扬州市宝应县中考化学二模试卷
试卷更新日期:2017-06-29 类型:中考模拟
一、单项选择题
-
1. 崇明着力打造生态示范区,下列做法不符合这一主题的是( )A、爱护花草树木 B、随意排放废水 C、分类回收垃圾 D、绿色低碳出行2. 下列变化中属于化学变化的是( )A、酒精挥发 B、石蜡熔化 C、轮胎爆炸 D、粮食酿酒3. 下列物质由分子构成的是( )A、氨气 B、氯化钠 C、金刚石 D、汞4. 三氧化硫(SO3)中硫元素的化合价是( )A、﹣2 B、﹣6 C、+3 D、+65. 下列气体会造成酸雨污染的是( )A、一氧化碳 B、二氧化碳 C、二氧化硫 D、氢气6. 垃圾分类从你我他开始.用过的金属饮料罐属于( )A、
 可回收物
B、
可回收物
B、 有害垃圾
C、
有害垃圾
C、 厨余垃圾
D、
厨余垃圾
D、 其它垃圾
7. 盛有下列物质的烧杯露置于空气中,一段时间后,烧杯的总质量减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠8. 人体缺碘易引发的病症是( )A、贫血 B、夜盲症 C、骨质疏松 D、甲状腺肿大9. 下列化肥属于复合肥的是( )A、NH4NO3 B、Ca(H2PO4)2 C、CO(NH2)2 D、KNO310. 钛元素在化合物中一般显+4价,它在元素周期表中的部分信息如图所示,下列有关钛元素的说法不正确的是( )
其它垃圾
7. 盛有下列物质的烧杯露置于空气中,一段时间后,烧杯的总质量减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠8. 人体缺碘易引发的病症是( )A、贫血 B、夜盲症 C、骨质疏松 D、甲状腺肿大9. 下列化肥属于复合肥的是( )A、NH4NO3 B、Ca(H2PO4)2 C、CO(NH2)2 D、KNO310. 钛元素在化合物中一般显+4价,它在元素周期表中的部分信息如图所示,下列有关钛元素的说法不正确的是( )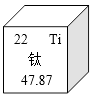 A、原子序数为22 B、属于金属元素 C、相对原子质量为47.87g D、与氯元素组成的化合物的化学式为TiCl411. 我市盛产茶叶,“金山翠芽”绿茶中享誉省内外.绿茶中的单宁酸具有抑制血压上升、清热解毒等功效,其化学式为C76H57O46 , 下列有关单宁酸说法正确的是( )A、一个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成 B、单宁酸分子中碳、氢、氧元素质量比为38:26:23 C、单宁酸中氧元素的质量分数最高 D、一个单宁酸分子中含26个氢分子12. 物质的用途与性质对应关系不合理的是( )A、石墨做电池电极﹣导电性 B、一氧化碳冶炼金属﹣可燃性 C、金刚石切割玻璃﹣硬度大 D、活性炭除异味﹣吸附性13. 配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒14. 实验现象描述错误的是( )A、红磷在空气中燃烧,产生大量白烟 B、木炭在氧气中燃烧,发出红光,生成无色气体 C、铁丝在氧气中燃烧,火星四射,生成黑色固体 D、硫粉在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味的气体15. 下列说法正确的是( )A、甲醛用于泡发鱿鱼等水产品 B、用水不能区分NaOH和NH4NO3两种固体,因为它们的水溶液都是无色的 C、发生煤气中毒,立即将中毒人员移到通风的地方救治 D、档案资料起火,立即用水灭火
A、原子序数为22 B、属于金属元素 C、相对原子质量为47.87g D、与氯元素组成的化合物的化学式为TiCl411. 我市盛产茶叶,“金山翠芽”绿茶中享誉省内外.绿茶中的单宁酸具有抑制血压上升、清热解毒等功效,其化学式为C76H57O46 , 下列有关单宁酸说法正确的是( )A、一个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成 B、单宁酸分子中碳、氢、氧元素质量比为38:26:23 C、单宁酸中氧元素的质量分数最高 D、一个单宁酸分子中含26个氢分子12. 物质的用途与性质对应关系不合理的是( )A、石墨做电池电极﹣导电性 B、一氧化碳冶炼金属﹣可燃性 C、金刚石切割玻璃﹣硬度大 D、活性炭除异味﹣吸附性13. 配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒14. 实验现象描述错误的是( )A、红磷在空气中燃烧,产生大量白烟 B、木炭在氧气中燃烧,发出红光,生成无色气体 C、铁丝在氧气中燃烧,火星四射,生成黑色固体 D、硫粉在氧气中燃烧,产生蓝紫色火焰,生成有刺激性气味的气体15. 下列说法正确的是( )A、甲醛用于泡发鱿鱼等水产品 B、用水不能区分NaOH和NH4NO3两种固体,因为它们的水溶液都是无色的 C、发生煤气中毒,立即将中毒人员移到通风的地方救治 D、档案资料起火,立即用水灭火二、不定项选择题
-
16.
如图是自来水消毒过程中发生反应的微观示意图,下列说法正确的是( )
 A、该反应属于置换反应 B、参加反应的A、B 两物质质量比为 1:1 C、该反应中涉及两种氧化物 D、反应前后氯元素的化合价发生了改变17. 除去物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )
A、该反应属于置换反应 B、参加反应的A、B 两物质质量比为 1:1 C、该反应中涉及两种氧化物 D、反应前后氯元素的化合价发生了改变17. 除去物质中混有的少量杂质,所选用的试剂及操作方法正确的是( )物质
杂质
除杂质应选用的试剂和操作方法
A
N2
O2
铁丝,点燃
B
CaO
CaCO3
高温煅烧
C
KNO3溶液
KOH溶液
加适量的CuSO4溶液,过滤
D
FeSO4溶液
CuSO4溶液
加过量的铁粉,过滤
A、A B、B C、C D、D18. 如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )①生石灰和水;③稀硫酸和锌;⑨水和氢氧化钠;④水和硝酸铵.
 A、①②③④ B、①②③ C、①②④ D、②⑨④19. 图象能正确反映对应变化关系的是( )A、
A、①②③④ B、①②③ C、①②④ D、②⑨④19. 图象能正确反映对应变化关系的是( )A、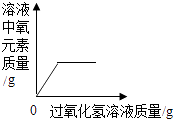 向一定量的MnO2中加入H2O2溶液
B、
向一定量的MnO2中加入H2O2溶液
B、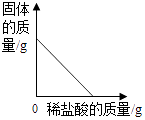 向黄铜粉末(锌铜混合物)中加稀盐酸
C、
向黄铜粉末(锌铜混合物)中加稀盐酸
C、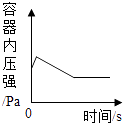 红磷在盛有空气的密闭容器中燃烧
D、
红磷在盛有空气的密闭容器中燃烧
D、 加热一定量的氯酸钾和二氧化锰固体混合物
20. 铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料,制备FeCO3和Fe2O3的一种流程如图所示:
加热一定量的氯酸钾和二氧化锰固体混合物
20. 铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料,制备FeCO3和Fe2O3的一种流程如图所示:资料:1、FeCO3 FeO+CO2↑,4FeO+O2=2Fe2O3;2、FeSO4+2NH4H CO3=FeCO3↓+( NH4)2 SO4+H2O+CO2↑

下列说法正确的是( )
A、反应Ⅰ需控制温度在35℃以下,原因可能是因为NH4H CO3受热易分解 B、滤液中的溶质只有( NH4)2 SO4 C、在空气中煅烧23.2g的FeCO3 , 得到Fe2O3和FeO的混合物15.2g.则生成Fe2O38.0g D、在空气中充分煅烧FeCO3 , 若煅烧时间越多,则最终所得固体的质量越小三、填空题
-
21. 回答下列问题:(1)、用相应的化学符号填空:
①氮元素;
②最简单的有机物;
③三个硫酸根离子;
④二氧化氯中氯元素的化合价 .
(2)、选择相应物质的字母填空:A.熟石灰 B.石墨 C.纯碱 D.碳酸钙
①可作干电池电极的是;
②可用作补钙剂的是;
③用于中和土壤酸性的是;
④厨房中用于洗涤油污中的“碱”是 .
(3)、写出下列化学反应的化学方程式:①铁在氧气中燃烧:;
②高锰酸钾受热分解:;
③绿色植物的光合作用:;
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体: .
22. 化学与我们的生活密切相关.(1)、制作饺子的原料有:面粉、肉馅、蔬菜、植物油、调味剂等,其中富含糖类的是 .(2)、小明去采摘草莓.①草莓大棚所用的塑料薄膜属于(填序号,下同);
A.有机合成材料 B.无机材料 C.复合材料
②用发酵后的牛奶做肥料,种出的草莓又大又甜.发酵后的牛奶含有C、H、O和N等元素.浇“牛奶”相当于施加了 .
A.氮肥 B. 磷肥 C.钾肥 D.复合肥
(3)、①金属材料在国防建设中起着重要的作用.
工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为;
②小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2所示的两个实验:
Ⅰ.实验1中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不合理,理由是;
Ⅱ.通过实验2,可证明铁的活动性比铜强,反应的化学方程式是 .
23. 水与人类的生活和生产密切相关,请回答下列问题:(1)、图1是水的电解实验,试管a中产生的气体为 , 该反应的化学方程式为 . (2)、将浑浊的河水用图2所示的简易净水器进行净化,其中活性炭的主要作用是 , 生活中降低水的硬度的方法是 .
(2)、将浑浊的河水用图2所示的简易净水器进行净化,其中活性炭的主要作用是 , 生活中降低水的硬度的方法是 . (3)、图3实验中,水的作用为 , 若用pH试纸检测实验结束后集气瓶中液体的pH,则液体的pH7(填“<”或“=”或“>”).
(3)、图3实验中,水的作用为 , 若用pH试纸检测实验结束后集气瓶中液体的pH,则液体的pH7(填“<”或“=”或“>”). (4)、图4为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.
(4)、图4为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.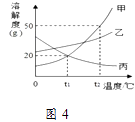
①t1℃时,丙物质的溶解度为;
②t2℃ 时将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为 g;
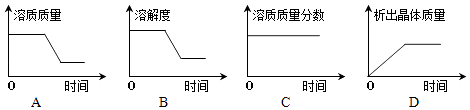
③将t2℃时乙的不饱和溶液逐渐冷却至t1℃,下图中有关量随时间变化的趋势一定错误的是 .
四、实验题
-
24.
用如图常用实验装置制取常见的气体,并进行相应性质实验.

实验一:实验室中可用KClO3在MnO2催化下受热分解制取氧气,完全反应后对混合物进行
分离回收并进行相关性质实验,实验操作如图所示(MnO2难溶于水).
(1)、写出图A中发生反应的化学方程式 .(2)、图B操作的名称是 , 图C操作中的一处明显错误是 , 图D操作中,当看到时停止加热.(3)、实验二:若用图1装置制取二氧化碳气体,为了便于控制反应随时发生和停止,多孔隔板合适的
位置是处(选填“a”、“b”或“c”),不适宜用作多孔隔板的材料是 .
A.铁 B.塑料C.铜片D.石墨
(4)、用图1装置制取并收集两试管CO2气体,分别倒扣入图2盛有等体积NaOH溶液和水的 烧杯中,该组对比实验产生的现象说明 .(5)、为了进一步探究CO2与NaOH溶液的反应,取图2甲烧杯实验后的溶液于图3(A~D)四支试管中,分别滴入四种不同类别的试剂,B中加入的是 . 四种方案中不合理的是(填字母),理由是 .25. 杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH)2溶液浸杂卤石制备硫酸钾,工艺流程如下:
已知:
物质
CaSO4
K2SO4
Mg(OH)2
溶解度/g(25℃)
0.28
11.1
0.00084
(1)、操作1的名称为 , 所需的玻璃仪器有玻璃棒、烧杯、 , 玻璃棒的作用是 .(2)、滤渣的主要成分有和 .(3)、“除杂”环节中,先加入溶液(填字母,下同),经搅拌等操作后,过滤,再加入溶液调滤液pH至中性.
a.K2CO3 b.Na2CO3 c.稀硫酸 d.稀盐酸
(4)、操作2的步骤是蒸发浓缩、、过滤、洗涤.(5)、洗涤硫酸钾最好选用 .a.30℃的水 b.饱和的硫酸钠溶液 c.饱和的硫酸钾溶液.
五、(本题共1小题)
-
26. 碳酸镁水合物是制备镁产品的中间体.
【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:
 (1)、沉淀过程的化学方程式为:
(1)、沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2 .
(2)、沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为(填字母).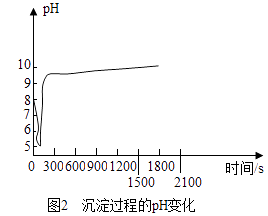
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)、沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26﹣1所示.
表26﹣1 不同反应温度下的水合碳酸镁
温度(℃)
产物
46.95
MgCO3•3H2O
47.95
MgCO3•3H2O
48.95
MgCO3•3H2O
49.95
Mg5(OH)2(CO3)4•4H2O
则沉淀过程选择的温度为 , 理由是 .
(4)、【测定MgCO3•3H2O的纯度】利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有 .
(5)、C中反应生成CaCO3的化学方程式为;D中碱石灰的作用为 .(6)、下列各项措施中,不能提高测定准确度的是(填标号).a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(7)、实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO3•3H2O的纯度(写出计算过程).(8)、小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有 .(9)、若获取MgCO3•3H2O的样品中含有少量Mg5(OH)2(CO3)4•4H2O,则产品中镁元素的质量分数(填“偏大”“不变”或“偏小”,下同),样品中MgCO3•3H2O的纯度 .