2017年江苏省无锡市江阴市长泾片中考化学二模试卷
试卷更新日期:2017-06-29 类型:中考模拟
一、选择题
-
1. 下列变化属于物理变化的是( )A、干冰升华 B、百炼成钢 C、葡萄酿酒 D、水果腐烂2. 分类是学习和研究化学的常用方法.下列物质分类正确的是( )A、有机物:甲烷、二氧化碳 B、氧化物:水、二氧化锰 C、混合物:自来水、冰水共存物 D、碱类:烧碱、纯碱3. 下列化学用语表示正确的是( )A、氧化铁:FeO B、二个氢原子:2H C、正二价的镁元素:Mg+2 D、铝与盐酸的反应:Al+2HCl=AlCl2+H2↑4. 下列实验操作正确的是( )A、
 点燃酒精灯
B、
点燃酒精灯
B、 滴加液体
C、
滴加液体
C、 加热液体
D、
加热液体
D、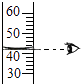 读取液体体积
5. 下列有关实验现象的描述,正确的是( )
读取液体体积
5. 下列有关实验现象的描述,正确的是( )
A、镁条在空气中燃烧发出蓝紫色火焰,产生大量白烟 B、电解水正极一侧得到的气体能使带火星的木条复燃 C、细铁丝在氧气中燃烧,火星四射,生成红棕色固体 D、打开浓硫酸的试剂瓶盖时,瓶口有白雾产生6. 关于“舌尖上的化学”,下列说法不科学的是( )A、为了身体健康,必须均衡膳食 B、为预防缺碘性疾病,可食用适量海带 C、为延长食品保质期,在食品中添加大量防腐剂 D、为了使面包松软可口,在制作时加入碳酸氢钠7. 如图是某化学反应的微观示意图,下列说法中正确的是( )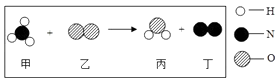 A、该反应属于置换反应 B、反应中甲、乙的质量比为17﹕32 C、甲物质含有4个原子 D、反应物中只有一种元素的化合价改变8. 下列实验进行中的现象或实验原理正确的是( )A、白磷始终不燃烧
A、该反应属于置换反应 B、反应中甲、乙的质量比为17﹕32 C、甲物质含有4个原子 D、反应物中只有一种元素的化合价改变8. 下列实验进行中的现象或实验原理正确的是( )A、白磷始终不燃烧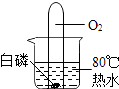 B、小气球变瘪
B、小气球变瘪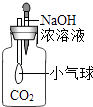 C、U型管内液面左高右低
C、U型管内液面左高右低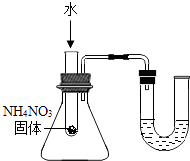 D、验证Fe、Cu、Ag的金属活动性强弱
D、验证Fe、Cu、Ag的金属活动性强弱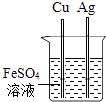 9. 在CuCl2和AlCl3的混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是( )A、Cu B、Cu和Al C、Zn和Cu D、Cu、Al和Zn10. 如图是A,B,C三种物质的溶解度曲线,下列说法不正确的是( )
9. 在CuCl2和AlCl3的混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是( )A、Cu B、Cu和Al C、Zn和Cu D、Cu、Al和Zn10. 如图是A,B,C三种物质的溶解度曲线,下列说法不正确的是( )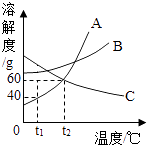 A、t1℃时,A,B,C三种物质的溶解度由大到小的顺序是C>B>A B、当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A C、t2℃时,A和C的饱和溶液中含有相同质量的溶质 D、将t2℃时A,B,C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是B>C>A11. 下列除去杂质所用的药品或方法,不正确的是( )
A、t1℃时,A,B,C三种物质的溶解度由大到小的顺序是C>B>A B、当A中含有少量B时,可以通过冷却热饱和溶液的方法提纯A C、t2℃时,A和C的饱和溶液中含有相同质量的溶质 D、将t2℃时A,B,C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是B>C>A11. 下列除去杂质所用的药品或方法,不正确的是( )选项
物质
杂质
除杂药品或方法
A
CaCl2
盐 酸
过量的碳酸钙、过滤
B
CaO
CaCO3
适量的稀盐酸
C
N2
O2
灼热的铜网
D
CO
CO2
足量的氢氧化钠溶液、浓硫酸
A、A B、B C、C D、D12. 以下归纳和总结完全正确的一组是( )A、对现象的认识
B、对安全的认识
①镁在空气中燃烧生成白色固体
②紫色石蕊溶液能使稀盐酸变红
③羊毛灼烧后有烧焦羽毛气味
①霉变的大米必须洗净后方可食用
②可燃性气体点燃前必须验纯
③家中天然气泄漏立即关闭阀门轻轻开窗
C、对原理等的认识
D、对科学家贡献的认识
①用洗涤剂清洗油污是利用溶解的原理
②闻到花香是因为分子在不停地运动
③用排水法收集氧气,是因为氧气难溶于水
①拉瓦锡﹣﹣测定空气的组成
②门捷列夫﹣﹣元素周期律的发现
③道尔顿﹣﹣原子论的创立
A、A B、B C、C D、D13. 由氢氧化镁和氧化镁组成的混合物,测得其中含镁元素的质量分数为48%.取该混合物40克,将其投入到适量的稀硫酸中恰好完全反应,所得溶液中溶质的质量为( )A、24克 B、48克 C、72克 D、96克14. 有一包白色固体,可能含有FeCl3、CaCO3、NaOH、Ba(OH)2、BaCl2、Na2SO4中的几种.为确定其组成,取适量试样进行下列实验.请根据实验现象判断:①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2 , 生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
A、由①得原白色固体中一定不含FeCl3 , 一定含有CaCO3 B、由②③得原白色固体中一定含有Ba(OH)2 , 一定不含有Na2SO4 C、由实验现象判断,白色固体中至少有3种固体 D、由实验现象判断,白色固体的组成可有5种情况二、非选择题
-
15. 我们生活在一个丰富多彩的物质世界中,人类的生产、生活和化学密不可分.(1)、用适当的化学符号填空:
①常用来改良酸性土壤的碱②汽水中的酸
③人体中含量最多的元素④硝酸铵中的阳离子
(2)、归纳总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应).
①验证反应甲:小明将无色酚酞溶液滴入NaOH溶液中,溶液呈色.
②小明用示意图2来说明反应丙的发生,写出该反应的化学方程式: .
③请你写出一个化学反应方程式,满足反应丁能够发生 , 该反应的基本类型是 .
16. 如图1的A~F是实验室制备某些常见气体的装置示意图.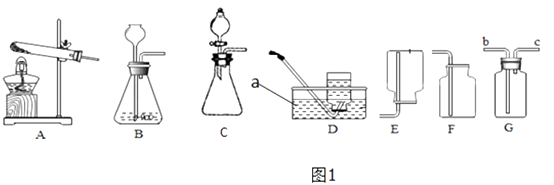 (1)、装置图中仪器a的名称为 .(2)、可通过加热二氧化锰和氯酸钾混合物制取氧气,反应中二氧化锰的作用是;为了得到较纯净的氧气,选择的收集装置是;该反应的化学方程式是 .(3)、实验室利用B装置制取二氧化碳的化学方程式为 , 如果利用G装置收集二氧化碳,气体应从 端通入(填“b”或“c”);用C装置代替B装置作为发生装置,其主要优点是 .(4)、查阅资料可知:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与无色硝酸溶液反应,其化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.反应生成的NO2是红棕色、有刺激性气味的有毒气体.可用图2所示装置进行实验,请回答:
(1)、装置图中仪器a的名称为 .(2)、可通过加热二氧化锰和氯酸钾混合物制取氧气,反应中二氧化锰的作用是;为了得到较纯净的氧气,选择的收集装置是;该反应的化学方程式是 .(3)、实验室利用B装置制取二氧化碳的化学方程式为 , 如果利用G装置收集二氧化碳,气体应从 端通入(填“b”或“c”);用C装置代替B装置作为发生装置,其主要优点是 .(4)、查阅资料可知:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与无色硝酸溶液反应,其化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.反应生成的NO2是红棕色、有刺激性气味的有毒气体.可用图2所示装置进行实验,请回答: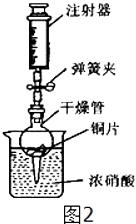
①检查装置的气密性:关闭弹簧夹,将干燥管放入带有水的烧杯中,若观察到 , 则表明该装置的气密性良好.
②打开弹簧夹,用注射器慢慢抽取干燥管内的气体,浓硝酸沿着干燥管慢慢上升,直到硝酸与铜片接触,停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象是: .
③上述实验完成后,须用足量NaOH溶液将气体吸收,其目的是 .
17. 氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO等杂质)来制取氧化锌,其流程如图所示: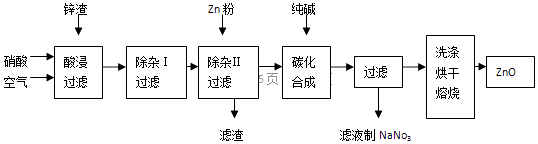
信息:1、3FeO+10HNO3═3Fe(NO3)3+NO+5H2O,NO有毒,能与氧气和水反应生成硝酸.2、在“除杂Ⅰ”步骤中,只有铁离子能形成氢氧化铁沉淀.
回答下列问题
(1)、在酸浸过程中,经常要保持酸过量,理由是;通入空气的目的是:①起搅拌作用,使反应充分,② . 通入空气反应的化学方程式为 .(2)、在“除杂Ⅰ”步骤中,加入一种金属氧化物与过量的硝酸反应,使溶液pH升高为4左右,请结合本厂实际,可加入的物质是A、ZnO B、FeO C、Fe2O3 D、CuO(3)、为了使产品更加纯净,在“除杂Ⅱ”步骤中,滤渣的成分是 .(4)、在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],还生成一种能使澄清石灰水变浑浊的气体氧化物.请写出碳化合成步骤的化学方程式 .18. 纯碱是重要的化工原料(一)制备探究:如图是工业生产纯碱的主要流程示意图.
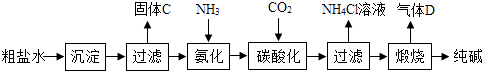
[查阅资料]
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)、写出除去粗盐水中MgCl2的化学方程式: .(2)、在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是 , “碳酸化”时,NaCl、NH3、CO2和H2O相互作用析出NaHCO3 , 写出该反应的化学方程式 .(3)、“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是;(4)、煅烧制得纯碱的化学方程式是 .(5)、(二)成分探究[提出问题]纯碱样品中含有哪些杂质?
[猜想]
猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:NaHCO3和NaCl
[实验探究]确定纯碱中是否含NaHCO3 . 实验装置和主要实验步骤如下:
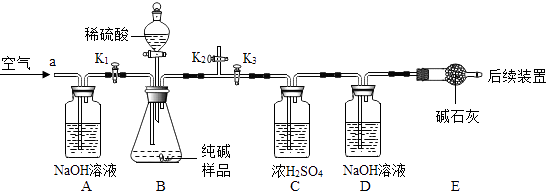
①称量D、E装置总质量为200.0g,检查装置的气密性,将10.6 g纯碱试样放入锥形瓶中,按上图组装仪器,进行如下操作…………,后缓缓鼓入一段时间空气;
②按一定要求正确操作后,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1 , 从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
[实验讨论]
步骤①中“如下操作”是指;
(6)、装置B中一定发生的化学反应方程式为:;(7)、装置B中生成CO2的质量为4.84g,通过计算说明纯碱中 含NaHCO3(填字母).(写出计算过程)A、一定 B、一定不 C、可能 D、无法确定(8)、另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足条件时,样品中含有NaCl.