2017年江苏省南通市启东市中考化学一模试卷
试卷更新日期:2017-06-29 类型:中考模拟
一、选择题
-
1. 日常生活中的下列变化属于化学变化的是( )A、河水静置后变澄清 B、糖放入水中消失 C、菜刀放置后生锈 D、瓷碗掉地上破碎2. 下图中的实验方法或操作正确的是( )A、
 稀释浓硫酸
B、
稀释浓硫酸
B、 向试管中加入锌粒
C、
向试管中加入锌粒
C、 加热液体
D、
加热液体
D、 向试管内倾倒液体
3. 分类法是化学研究的重要方法.下列分类正确的是( )A、非金属元素:F、Si、Hg B、盐:氯化钠、纯碱、小苏打 C、混合物:空气、石油、冰水混合物 D、合成材料:塑料、羊毛、合金4. 甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示.根据微观示意图得出的结论正确的是( )
向试管内倾倒液体
3. 分类法是化学研究的重要方法.下列分类正确的是( )A、非金属元素:F、Si、Hg B、盐:氯化钠、纯碱、小苏打 C、混合物:空气、石油、冰水混合物 D、合成材料:塑料、羊毛、合金4. 甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示.根据微观示意图得出的结论正确的是( )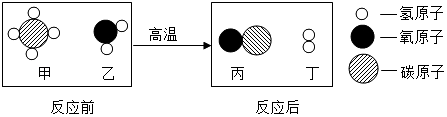 A、该反应属于置换反应 B、该反应中含氢元素的化合物有3种 C、该反应中甲、乙的质量比为8:9 D、甲烷是由碳、氢原子构成的有机物5. 某化学兴趣小组用青霉素的药瓶、注射器和眼药水瓶设计了如图所示的实验装置,用于检验二氧化碳的性质.缓缓推动注射器活塞,滴入稀硫酸后,在眼药水瓶中即可产生二氧化碳气体,下列有关说法错误的是( )
A、该反应属于置换反应 B、该反应中含氢元素的化合物有3种 C、该反应中甲、乙的质量比为8:9 D、甲烷是由碳、氢原子构成的有机物5. 某化学兴趣小组用青霉素的药瓶、注射器和眼药水瓶设计了如图所示的实验装置,用于检验二氧化碳的性质.缓缓推动注射器活塞,滴入稀硫酸后,在眼药水瓶中即可产生二氧化碳气体,下列有关说法错误的是( ) A、该实验中不能用浓盐酸代替稀硫酸 B、上下两片滤纸条变红,只能证明CO2与水反应生成碳酸 C、该实验能验证二氧化碳不能燃烧,也不支持燃烧 D、该微型实验具有所用药品量少,现象明显,操作简单等优点6. 下列归纳总结完全正确的一组是( )
A、该实验中不能用浓盐酸代替稀硫酸 B、上下两片滤纸条变红,只能证明CO2与水反应生成碳酸 C、该实验能验证二氧化碳不能燃烧,也不支持燃烧 D、该微型实验具有所用药品量少,现象明显,操作简单等优点6. 下列归纳总结完全正确的一组是( )A.物质性质和用途
B.物质保存方法及解释
①碳酸氢钠用于焙制面包﹣﹣能与酸反应产生气体
②食盐消除地面积雪﹣﹣溶于水放热使雪融化
①浓盐酸密封保存﹣﹣防止挥发
②白磷在冷水中保存﹣﹣隔绝空气
C.化学和生活
D.结构与性质
①衣服上的油污﹣﹣用汽油除去
②水壶中的水垢﹣﹣用食盐水浸泡除去
①金刚石和石墨物理性质不同﹣﹣组成元素不同
②元素的种类﹣﹣由最外层电子数决定
A、A B、B C、C D、D7. 推理是研究和学习化学的一种重要方法,以下推理正确的是( )A、碱中都含有氢氧根,所以碱中一定都含有氢元素 B、酸能使石蕊溶液变红,通入CO2后石蕊溶液变红,所以CO2是酸 C、有机物都含有碳元素,所以含有碳元素的化合物都是有机物 D、某物质在O2中完全燃烧,生成了氧化物,则该物质一定是单质8. 如图为甲乙两物质的溶解度曲线,下列说法正确的是( ) A、甲的溶解度大于乙的溶解度 B、t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15% C、要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法 D、t2℃时,将50克甲物质放入100克水中,得到溶液的质量为150克9. 中考复习阶段,小刚同学梳理了以下知识:①NH4NO3属于复合肥料,溶于水溶液温度降低;②利用铁、银、Cu(NO3)2溶液能探究出铜、铁、银的金属活动性顺序;③用湿润的pH试纸来测定稀盐酸的酸碱度;④洗涤剂去除油污是因为洗涤剂具有乳化作用;⑤催化剂只能加快反应速率; ⑥稀有气体原子的最外层电子数都为8;其中正确的是( )A、②④ B、④⑥ C、①②④ D、②③⑤10. 为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )
A、甲的溶解度大于乙的溶解度 B、t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15% C、要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法 D、t2℃时,将50克甲物质放入100克水中,得到溶液的质量为150克9. 中考复习阶段,小刚同学梳理了以下知识:①NH4NO3属于复合肥料,溶于水溶液温度降低;②利用铁、银、Cu(NO3)2溶液能探究出铜、铁、银的金属活动性顺序;③用湿润的pH试纸来测定稀盐酸的酸碱度;④洗涤剂去除油污是因为洗涤剂具有乳化作用;⑤催化剂只能加快反应速率; ⑥稀有气体原子的最外层电子数都为8;其中正确的是( )A、②④ B、④⑥ C、①②④ D、②③⑤10. 为了除去下表物质中的杂质(括号内为杂质),所选试剂(过量)及操作方法均正确的是( )物质
选用试剂(过量)
操作方法
A
Cu(CuO)
氧气
通入氧气并加热
B
CO2(HCl)
氢氧化钠溶液
气体通过盛有氢氧化钠溶液的洗气瓶
C
N2(O2)
铜网
气体通过炽热的铜网
D
KCl溶液(K2CO3)
氯化钙溶液
加入氯化钙溶液充分反应后过滤
A、A B、B C、C D、D二、非选择题
-
11. 化学就在我们身边,它与我们的生活息息相关.(1)、周末同学们决定去郊游,小明提议“绿色”出行,如图是郊游用的交通工具,请回答下列问题.

①图中所标示的各部件中,属于合成材料的是(填序号).
②自行车的闸线为钢丝,说明金属具有性.
③小明带了一些新鲜水果,主要是为了补充(填营养素名称).
④旅游途中,贝贝发现路边农田里的作物出现了倒伏现象,大家建议应施肥.
⑤旅游回来后,小明给车子零件涂油防止生锈,铁生锈原理,铁与共同作用的结果
(2)、H、O、C、Ca是初中化学常见的几种元素,请选用适当的元素写出符合下列要求的物质的化学式.①最常用的溶剂; ②可用作补钙剂的盐;
③可用于改良酸性土壤的碱;④可用作调味品的酸 .
12. p型透明导电化合物CuAlO2具有良好的热电性能,在热电转换领域具有广阔的应用前景.银铜合金广泛用于航空工业,以下为从航空切割废料中回收银并制备CuAlO2的工艺流程.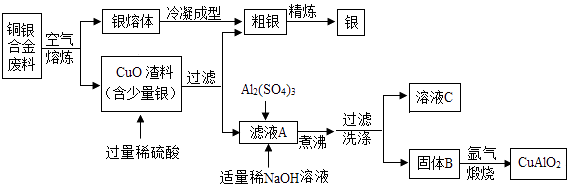
【资料】Ⅰ.难溶性碱受热易分解为两种氧化物,Cu(OH)2、Al(OH)3完全分解的温度分别为80℃和450℃;
Ⅱ.CuAlO2高温易分解、受热易氧化.银在空气中不易被氧化.
请回答下列问题:
(1)、CuAlO2中铜元素的化合价为 , 过滤后所得滤液A中的溶质为 .(2)、煮沸过程中发生反应的化学方程式为 .(3)、固体B在煅烧时发生的其中一个反应方程式为4CuO+2Al2O3 4CuAlO2+X↑,气体X的化学式为 .(4)、“煅烧”时温度须控制在1042﹣1085℃范围内且在氩气中进行,其原因是 .13.如图为实验室常用的实验装置.回答问题:
 (1)、标号仪器的名称:①;② .(2)、A、F组合制氧气,氧气收集完毕,应先(填“熄灭酒精灯”或“从水中取出导气管”).(3)、用B、D组合制取气体的化学反应方程式 . 若将发生装置由B改为C,其优点是 .(4)、硫化氢气体(H2S)有毒,溶于水形成酸.用块状硫化亚铁(FeS)和稀硫酸发生复分解反应制得H2S,反应化学方程式为 .
(1)、标号仪器的名称:①;② .(2)、A、F组合制氧气,氧气收集完毕,应先(填“熄灭酒精灯”或“从水中取出导气管”).(3)、用B、D组合制取气体的化学反应方程式 . 若将发生装置由B改为C,其优点是 .(4)、硫化氢气体(H2S)有毒,溶于水形成酸.用块状硫化亚铁(FeS)和稀硫酸发生复分解反应制得H2S,反应化学方程式为 .某同学用如图G、H、I组合收集H2S.
①G收集H2S,说明其密度比空气(填“大”或“小”).
②各装置的作用:H、I .
14. 某校化学兴趣小组对氢氧化钠溶液与稀盐酸混合后的有关问题,进行了如下探究,请你一起参与此次探究之旅.(1)、探究一:判断氢氧化钠溶液与稀盐酸混合后是否恰好完全中和【方案设计】小丽、小林两位同学设计了如下方案进行探究:
设计者
方案步骤
预估现象
预估结论
小丽
用一根洁净的玻璃棒 , 把试纸呈现的颜色与标准比色卡对照
pH=7
恰好完全中和
小林
取少量反应后的溶液于一支试管中,并向试管中滴加稀硝酸和硝酸银溶液
有白色沉淀生产
盐酸过量,没有完全中和
(2)、【方案评价】请判断以上设计的两个方案中,同学的方案是正确的.(3)、【方案反思】请分析另一个方案错误的原因: .(4)、探究二:氢氧化钠溶液与稀盐酸混合后,所得溶液中溶质的成分是什么?【作出猜想】小亮猜想:溶质有NaCl、HCl、NaOH小丽猜想:溶质只有NaCl
小林猜想:溶质有NaCl、HCl 你的猜想:溶质有(填化学式)
小丽认为小亮的猜想是错误的,她的理由是 .
(5)、【实验设计及验证】请你将下列实验报告填写完整:实验操作
实验现象
实验结论
取反应后的溶液于试管中,加入碳酸钠溶液
小林猜想正确
有蓝色沉淀生成
你的猜想正确
15. 漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应.Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.(1)、HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH (填“增大”或“减小”或“不变”).(2)、在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式 .(3)、有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3 .
【实验探究】限选试剂及仪器,盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
实验操作
实验现象
实验结论
①取少量样品于试管中,
有气体产生,
气体使石灰水变浑浊.
猜想2成立
②在上述反应后试管中加少量
(4)、现有实验后的HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如图实验方案:

【实验数据】上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应后,共记录了两组实验数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10g.
根据实验设计及有关数据进行分析与计算:
①m= .
②上述实验中100g混合溶液与mg溶质的质量分数为10.6%的Na2CO3溶液恰好完全反应,经过滤后所得“滤液”中溶质的质量分数为多少?(不考虑过滤中的损失,计算结果保留到小数点后一位.)