2017年江苏省泰州市中考化学试卷
试卷更新日期:2017-06-29 类型:中考真卷
一、选择题
-
1. 下列实验物质化学性质的是( )A、导热性 B、可燃性 C、挥发性 D、延展性2. 下列日常生活中的变化,属于物理变化的是( )A、菜刀生锈 B、面包发霉 C、粮食酿酒 D、电灯发光3. 下列化学用语书写正确的是( )A、镁元素 MG B、氧离子O﹣2 C、水银Hg D、2个氮原子N24. 科学家最近研发出用铝稼合金制备氧气的新门艺.稼原子的质子数为31,相对原子质量为70.则稼原子的核外电子数为( )A、31 B、39 C、70 D、1015. 下列实验操作不符合规范要求的是( )A、
 加粉末药品
B、
加粉末药品
B、 读液体体积
C、
读液体体积
C、 测定溶液pH
D、
测定溶液pH
D、 稀释浓硫酸
6. 下列物质属于不可回收垃圾的是( )A、旧报纸 B、废铁屑 C、口香糖 D、空矿泉水瓶7. 下列物质属于复合肥的是( )A、KNO3 B、CO(NH2)2 C、K2CO3 D、Ca3(PO4)28. 儿童体内缺少钙元素,易患的疾病是( )A、侏儒症 B、贫血症 C、甲状腺疾病 D、佝偻病9. 下列有关微粒的叙述错误的是( )A、金刚石由碳原子构成 B、水蒸发,分子间隙增大 C、氯化钠晶体有分子构成 D、化学反应前后,原子个数一定不变10. 下列说法错误的是( )A、硝酸铵溶于水,溶液温度升高 B、灼烧羊毛线,闻到一股烧焦羽毛的气味 C、用洗洁精洗去餐具上的油污,属于乳化在日常生活中的应用 D、工业上分离液态空气获得氧气,是利用液氧和液氮的沸点不同
稀释浓硫酸
6. 下列物质属于不可回收垃圾的是( )A、旧报纸 B、废铁屑 C、口香糖 D、空矿泉水瓶7. 下列物质属于复合肥的是( )A、KNO3 B、CO(NH2)2 C、K2CO3 D、Ca3(PO4)28. 儿童体内缺少钙元素,易患的疾病是( )A、侏儒症 B、贫血症 C、甲状腺疾病 D、佝偻病9. 下列有关微粒的叙述错误的是( )A、金刚石由碳原子构成 B、水蒸发,分子间隙增大 C、氯化钠晶体有分子构成 D、化学反应前后,原子个数一定不变10. 下列说法错误的是( )A、硝酸铵溶于水,溶液温度升高 B、灼烧羊毛线,闻到一股烧焦羽毛的气味 C、用洗洁精洗去餐具上的油污,属于乳化在日常生活中的应用 D、工业上分离液态空气获得氧气,是利用液氧和液氮的沸点不同二、选择题
-
11. 抗癌新药紫衫醇的化学式为C47H51NO4 , 下列说法正确的是( )A、紫衫醇属于有机高分子化合物 B、紫衫醇由 C、H、O、N四种元素组成C.紫衫醇中氮、氧元素的质量比为1:14 D、紫衫醇中碳元素的质量分数最大12. 如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
 A、30℃时,甲的饱和溶液溶质质量分数为40% B、20℃时,甲、乙的饱和溶液中所含溶质的质量一定相等 C、将等质量的甲、乙固体,分别配成30℃的饱和溶液,所需水的质量:甲>乙 D、将20℃时甲、乙的饱和溶液升温到30℃,所得甲、乙溶液的溶质质量分数相等13. 下列有关叙述正确的是( )A、溶液的基本特征是均一性,稳定性 B、用嘴吹灭蜡烛,其灭火原理是降低蜡烛的着火点 C、红磷燃烧产生大量的白雾,生成五氧化二磷固体 D、工业炼铁的原理:利用还原剂(CO)将铁从其化合物中置换出来14. 下列除去杂质(少量)的方法中正确的是( )
A、30℃时,甲的饱和溶液溶质质量分数为40% B、20℃时,甲、乙的饱和溶液中所含溶质的质量一定相等 C、将等质量的甲、乙固体,分别配成30℃的饱和溶液,所需水的质量:甲>乙 D、将20℃时甲、乙的饱和溶液升温到30℃,所得甲、乙溶液的溶质质量分数相等13. 下列有关叙述正确的是( )A、溶液的基本特征是均一性,稳定性 B、用嘴吹灭蜡烛,其灭火原理是降低蜡烛的着火点 C、红磷燃烧产生大量的白雾,生成五氧化二磷固体 D、工业炼铁的原理:利用还原剂(CO)将铁从其化合物中置换出来14. 下列除去杂质(少量)的方法中正确的是( )选项
物质
杂质
除杂方法
A
CaCO3固体
CaO
加足量稀盐酸,过滤
B
O2气体
H2O
通过浓硫酸洗气、收集
C
Cu(NO3)2溶液
AgNO3
加过量Fe粉,过滤
D
NaCl固体
KNO3
配成热饱和溶液,降温结晶、过滤、洗涤、干燥
A、A B、B C、C D、D15. “细菌冶金”的原理是利用氧化铁硫杆菌促使 黄铁矿(主要成分FeS2)氧化成硫酸铁和硫酸,并能为CO2和H2O合成有机物提供能量.流程如图,下列说法错误的是( ) A、反应①化学方程式:4FeS2+15O2+2X=2Fe2(SO4)3+2H2SO4 , X为H2O2 B、整个流程提高了能量的利用率 C、图中有机物一定不含氧元素 D、氧化铁硫杆菌在反应①中起催化作用
A、反应①化学方程式:4FeS2+15O2+2X=2Fe2(SO4)3+2H2SO4 , X为H2O2 B、整个流程提高了能量的利用率 C、图中有机物一定不含氧元素 D、氧化铁硫杆菌在反应①中起催化作用三、非选择题
-
16. 人类的生存与发展离不开化学.(1)、2017年5月,我国首架大型客机C919首飞,飞机材料中使用了大量的铝镁合金,它属于材料,铝制品具有“自我保护”能力,原因是 .(2)、2017年5月,我国载南海进行了天然气水合物(可燃冰)试开采,天然气的主要成分为(填化学式),其完全燃烧的化学方程式为 .(3)、活性炭净化水,是利用了它的性,生活中硬水软化的常用方法是 .(4)、硫酸型酸雨的形成与大气污染物中的气体有关,吸收该气体常用溶液.17. 完成下列实验.(1)、现提供下列装置:

①写出上图中B装置甲仪器的名称 .
②实验室用A装置进行高锰酸钾制氧气的实验,化学方程式为 , 用D装置收集氧气,气体由导管进入(填“a”或“b”)
③实验室用锌粒和稀盐酸制氢气,用C装置代替B装置的优点是:若要检验氧气中是否含有氯化氢气体,可将气体通过盛有溶液的D装置(填“AgNO3”或“饱和NaHCO3溶液”)
(2)、对一定质量的粗盐(含泥沙)进行初步提纯.①实验主要步骤:称量与、过滤、蒸发;实验中多次使用玻璃棒.过滤时它的作用是;蒸发时,待蒸发皿中出现时停止加热.利用余热将滤液蒸干.
②下列因素会导致获得的精盐质量偏小的是(填序号)
a.蒸发是液滴溅出 b.过滤时,滤纸破损
c.粗盐中加入过量的水 d.过滤后,滤纸上的泥沙未同水冲洗.
18. A~H为初中化学常见物质.其中A、E为氧化物且E为常见的液体,B、D为碱,H、G为单质,C为石灰石的主要成分,F为胃酸的主要成分;反应①为光合作用.它们之间的相互关系如图所示.其中“→”表示转化关系,“﹣”表示相互之间能发生反应(部分反应物、生成物以及反应条件省略).
请回答下列问题:
(1)、C的化学式为;E的化学式为 .(2)、B物质的一种用途为;反应③的基本反应类型为 .(3)、写出下列反应的化学方程式:①;②;③ .19. 某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
 (1)、实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
(1)、实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈色;
③通过对甲曲线的分析,下列说法错误的是(填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零
C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)、实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.①通过对乙曲线的分析,下列说法错误的是(填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度(填“增大”或“减小”).
(3)、拓展:①请根据示例仿写离子方程式.示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
20. 高纯硅可用于制备硅半导体材料.制备高纯硅的主要生产流程如图所示.信息:石英砂的主要成分是SiO2 , 反应①化学方程式
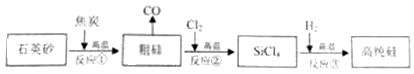 (1)、石英砂属于(填“纯净物”或“混合物”);SiCl4中硅元素的化合价为;写出合理处理中间产物CO的一种方法 .(2)、反应③反应除生成高纯硅外,同时还生成一种化合物.请写出此过程的化学方程式;(3)、反应③如果H2中混入O2 , 从安全角度考虑,可能引起的后果是 .(4)、若杂质不参加反应,利用反应①生产含硅质量分数为9O%的粗硅2.8吨,计算至少需要焦炭多少吨?
(1)、石英砂属于(填“纯净物”或“混合物”);SiCl4中硅元素的化合价为;写出合理处理中间产物CO的一种方法 .(2)、反应③反应除生成高纯硅外,同时还生成一种化合物.请写出此过程的化学方程式;(3)、反应③如果H2中混入O2 , 从安全角度考虑,可能引起的后果是 .(4)、若杂质不参加反应,利用反应①生产含硅质量分数为9O%的粗硅2.8吨,计算至少需要焦炭多少吨?