安徽省颍上三校联考2019-2020学年高三上学期化学第一次月考试卷
试卷更新日期:2019-10-10 类型:月考试卷
一、单选题(本大题共13小题,共28.0分)
-
1. 陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )A、“雨过天晴云破处”所描述的瓷器青色,来自氧化铁 B、闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 C、陶瓷是应用较早的人造材料,主要化学成分是硅酸盐 D、陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点2. 已知 是阿伏加德罗常数的值,下列说法错误的是( )A、 含有的中子数为1 B、 磷酸钠溶液含有的 数目为0.1 C、 被还原为 转移的电子数为6 D、48 g正丁烷和10 g异丁烷的混合物中共价键数目为133. 关于化合物2-苯基丙烯
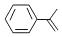 ,下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯4. 在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )A、
,下列说法正确的是( ) A、不能使稀高锰酸钾溶液褪色 B、可以发生加成聚合反应 C、分子中所有原子共平面 D、易溶于水及甲苯4. 在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )A、 B、
B、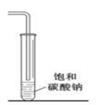 C、
C、 D、
D、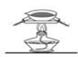 5. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
5. 今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )W
X
Y
Z
A、原子半径: B、常温常压下,Y单质为固态 C、气态氢化物热稳定性: D、X的最高价氧化物的水化物是强碱6. 下列化学方程式中,不能正确表达反应颜色变化的是( )A、向 溶液中加入足量Zn粉,溶液蓝色消失: B、澄清的石灰水久置后出现白色固体: C、 在空气中放置后由淡黄色变为白色: D、向 悬浊液中滴加足量 溶液出现红褐色沉淀:7. 下列实验现象与实验操作不相匹配的是( )实验操作
实验现象
A
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满 的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D
向盛有 溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A、A B、B C、C D、D8. 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量 HCl气体分子在 253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是( )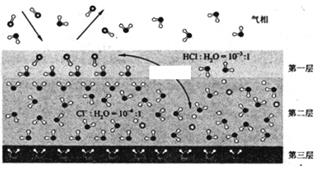 A、冰表面第一层中,HCl以分子形式存在 B、冰表面第二层中, 浓度为 设冰的密度为 ) C、冰表面第三层中,冰的氢键网络结构保持不变 D、冰表面各层之间,均存在可逆反应 HCl9. NaOH溶液滴定邻苯二甲酸氢钾邻苯二甲酸 的 , 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )
A、冰表面第一层中,HCl以分子形式存在 B、冰表面第二层中, 浓度为 设冰的密度为 ) C、冰表面第三层中,冰的氢键网络结构保持不变 D、冰表面各层之间,均存在可逆反应 HCl9. NaOH溶液滴定邻苯二甲酸氢钾邻苯二甲酸 的 , 溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )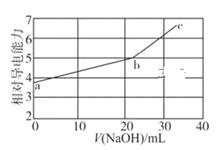 A、混合溶液的导电能力与离子浓度和种类有关 B、 与 的导电能力之和大于 的 C、b点的混合溶液 D、c点的混合溶液中,10. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉 是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A、混合溶液的导电能力与离子浓度和种类有关 B、 与 的导电能力之和大于 的 C、b点的混合溶液 D、c点的混合溶液中,10. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉 是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( ) A、图中 a和 b分别为 、 温度下 CdS在水中的溶解度 B、图中各点对应的 的关系为: C、向 m点的溶液中加入少量 固体,溶液组成由 m沿 mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动11. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
A、图中 a和 b分别为 、 温度下 CdS在水中的溶解度 B、图中各点对应的 的关系为: C、向 m点的溶液中加入少量 固体,溶液组成由 m沿 mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动11. 最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+该装置工作时,下列叙述错误的是( )
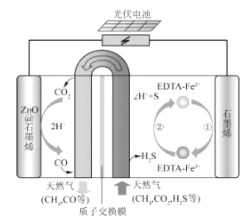 A、阴极的电极反应:CO2+2H++2e-=CO+H2O B、协同转化总反应:CO2+H2S=CO+H2O+S C、石墨烯上的电势比ZnO@石墨烯上的低 D、若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+ , 溶液需为酸性12. 利用生物燃料电池原理研究室温下氨的合成,电池工作时 在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )
A、阴极的电极反应:CO2+2H++2e-=CO+H2O B、协同转化总反应:CO2+H2S=CO+H2O+S C、石墨烯上的电势比ZnO@石墨烯上的低 D、若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+ , 溶液需为酸性12. 利用生物燃料电池原理研究室温下氨的合成,电池工作时 在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )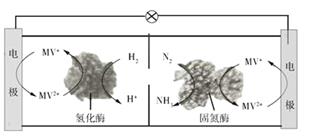 A、相比现有工业合成氨,该方法条件温和,同时还可提供电能 B、阴极区,在氢化酶作用下发生反应 C、正极区,固氮酶为催化剂, 发生还原反应生成 D、电池工作时质子通过交换膜由负极区向正极区移动13. 常温下将NaOH溶液滴加到己二酸 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
A、相比现有工业合成氨,该方法条件温和,同时还可提供电能 B、阴极区,在氢化酶作用下发生反应 C、正极区,固氮酶为催化剂, 发生还原反应生成 D、电池工作时质子通过交换膜由负极区向正极区移动13. 常温下将NaOH溶液滴加到己二酸 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是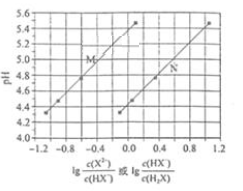 A、 的数量级为 B、曲线N表示pH与 的变化关系 C、NaHX溶液中 D、当混合溶液呈中性时,
A、 的数量级为 B、曲线N表示pH与 的变化关系 C、NaHX溶液中 D、当混合溶液呈中性时,二、简答题(本大题共3小题,共48.0分)
-
14. 近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(1)、Deacom发明的直接氧化法为:
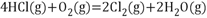 。如图为刚性容器中,进料浓度比 :c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:
。如图为刚性容器中,进料浓度比 :c(O2)分别等于1:1、4:1、7:1时HCl平衡转化率随温度变化的关系:

可知反应平衡常数 (填“大于”或“小于”。设HCl初始浓度为 ,根据进料浓度比 : :1的数据计算 列出计算式。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 : 过低、过高的不利影响分别是。
(2)、Deacom直接氧化法可按下列催化过程进行:则 的 。
(3)、在一定温度的条件下,进一步提高HCl的转化率的方法是。写出2种(4)、在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示: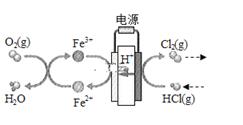
负极区发生的反应有写反应方程式。电路中转移1mol电子,需消耗氧气L(标准状况。
15. 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿还含Fe、Al、Mg、Zn、Ni、Si等元素制备,工艺如图所示。回答下列问题: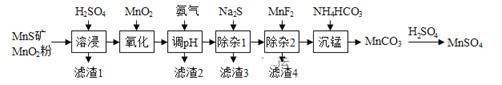
相关金属离子 形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)、“滤渣1”含有S和;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式。(2)、“氧化”中添加适量的 的作用是。(3)、“调pH”除铁和铝,溶液的pH范围应调节为~6之间。(4)、“除杂1”的目的是除去 和 ,“滤渣3”的主要成分是。(5)、“除杂2”的目的是生成 沉淀除去 若溶液酸度过高, 沉淀不完全,原因是。(6)、写出“沉锰”的离子方程式。(7)、层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为 ,其中Ni、Co、Mn的化合价分别为+2、+3、+4当 时,z=。16. 水煤气变换 是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:(1)、Shibata曾做过下列实验:①使纯 缓慢地通过处于 下的过量氧化钴 ,氧化钴部分被还原为金属钴 ,平衡后气体中 的物质的量分数为0.0250。②在同一温度下用CO还原 ,平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原 为 的倾向是CO (填“大于”或“小于”。
(2)、 时,在密闭容器中将等物质的量的 和 混合,采用适当的催化剂进行反应,则平衡时体系中 的物质的量分数为______填标号。A、 B、0.25 C、0.25~0.50 D、0.50 E、0.50>(3)、我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。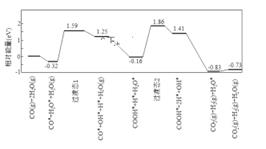
可知水煤气变换的 0(填 “大于”“等于”或“小于”,该历程中最大能垒活化能) eV,写出该步骤的化学方程式。
(4)、Shibata研究了 、 时水煤气变换中CO和 分压随时间变化关系如图所示。催化剂为氧化铁,实验初始时体系中的 和 相等、 和 相等。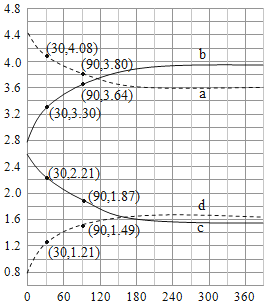
计算曲线a的反应在30~90min内的平均速率 = 时 和 随时间变化关系的曲线分别是、。 时 和 随时间变化关系的曲线分别是、。