2016-2017学年湖北省宜昌市部分示范高中教学协作体联考高二下学期期中化学试卷
试卷更新日期:2017-06-28 类型:期中考试
一、单项选择题
-
1. 中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是( )A、食盐 B、火碱 C、草木灰 D、胆矾2. 下列离子方程式中,属于水解反应的是( )A、HCOOH+H2O⇌HCOO﹣+H3O+ B、CO2+H2O⇌HCO3﹣+H+ C、CO32﹣+H2O⇌HCO3﹣+OH﹣ D、HS﹣+H2O⇌S2﹣+H3O+3. 醋酸在水中电离方程式可表示为:CH3COOH⇌CH3COO﹣+H+△H>0,下列操作能使H+浓度增大的是( )A、加入少量NaOH固体 B、加热升温10℃ C、加入锌粉 D、加入固体CH3COONa4. 锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( )
①锌极有气泡产生 ②电子由Zn经外电路流向Cu
③负极:Zn+2e﹣=Zn2+④Cu2+在溶液中由Cu棒向Zn棒迁移.
A、①②④ B、①②③ C、② D、②④5. 下列叙述的方法不正确的是( )A、金属的电化学腐蚀比化学腐蚀更普遍 B、用铝质铆钉铆接铁板,铁板易被腐蚀 C、钢铁在干燥空气中不易被腐蚀 D、用牺牲锌块的方法来保护船身6. 对H2O的电离平衡不产生影响的粒子是( )A、 B、 Fe3+
C、
B、 Fe3+
C、 D、
D、 7. 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
7. 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( ) A、电子的流向:负极→a电极→b电极→正极 B、a电极附近呈蓝色,b电极附近呈红色 C、逸出气体的体积,a电极的大于b电极的 D、Na+向a极移动8. 室温时,在由水电离出c(OH﹣)=1.0×10﹣12mol•L﹣1的溶液中,一定能大量共存的离子组是( )A、K+、Na+、HCO3﹣、Cl﹣ B、K+、MnO4﹣、Br﹣、Cl﹣ C、Na+、Cl﹣、NO3﹣、SO42﹣ D、Al3+、NH4+、Cl﹣、SO42﹣9. 0.1mol•L﹣1K2CO3溶液中下列表达式不正确的是( )A、c(K+)>c(CO32﹣)>c(OH﹣)>c (HCO3﹣)>c(H+) B、c(K+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣) C、c(HCO3﹣)+c(CO32﹣)+c(H2CO3)=0.1 mol•L﹣1 D、c(OH﹣)═c(H+)+2c(H2CO3)+c(HCO3﹣)10. 下列实验方法能够实现的是( )A、用10 mL 量筒量取 7.50 mL 稀盐酸 B、用托盘天平称取 25.20 g NaCl晶体 C、用广范 pH试纸测得某碱溶液的pH为12.7 D、用25 mL 碱式滴定管量取14.80 mL NaOH 溶液11. 下列说法正确的是( )A、0.1 mol•L﹣1的醋酸加水稀释, 减小 B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 C、体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 D、常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性12. 在相同温度时,100mL0.01mol•L﹣1的醋酸溶液与10mL 0.1mol•L﹣1的醋酸溶液相比较,下列数值中,前者大于后者的是( )A、H+的物质的量 B、醋酸的电离常数 C、中和时所需NaOH的量 D、CH3COOH的物质的量13. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A、电子的流向:负极→a电极→b电极→正极 B、a电极附近呈蓝色,b电极附近呈红色 C、逸出气体的体积,a电极的大于b电极的 D、Na+向a极移动8. 室温时,在由水电离出c(OH﹣)=1.0×10﹣12mol•L﹣1的溶液中,一定能大量共存的离子组是( )A、K+、Na+、HCO3﹣、Cl﹣ B、K+、MnO4﹣、Br﹣、Cl﹣ C、Na+、Cl﹣、NO3﹣、SO42﹣ D、Al3+、NH4+、Cl﹣、SO42﹣9. 0.1mol•L﹣1K2CO3溶液中下列表达式不正确的是( )A、c(K+)>c(CO32﹣)>c(OH﹣)>c (HCO3﹣)>c(H+) B、c(K+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣) C、c(HCO3﹣)+c(CO32﹣)+c(H2CO3)=0.1 mol•L﹣1 D、c(OH﹣)═c(H+)+2c(H2CO3)+c(HCO3﹣)10. 下列实验方法能够实现的是( )A、用10 mL 量筒量取 7.50 mL 稀盐酸 B、用托盘天平称取 25.20 g NaCl晶体 C、用广范 pH试纸测得某碱溶液的pH为12.7 D、用25 mL 碱式滴定管量取14.80 mL NaOH 溶液11. 下列说法正确的是( )A、0.1 mol•L﹣1的醋酸加水稀释, 减小 B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 C、体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 D、常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性12. 在相同温度时,100mL0.01mol•L﹣1的醋酸溶液与10mL 0.1mol•L﹣1的醋酸溶液相比较,下列数值中,前者大于后者的是( )A、H+的物质的量 B、醋酸的电离常数 C、中和时所需NaOH的量 D、CH3COOH的物质的量13. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )提示BaSO4(s)⇌Ba2+(aq)+SO42﹣(aq)的平衡常数Ksp=[Ba2+]•[SO42﹣],称为溶度积常数.
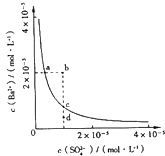 A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp14. 常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp14. 常温下,pH=10的X、Y两种碱溶液各1mL,分别加水稀释到100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )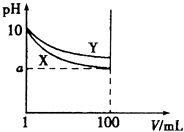 A、稀释前,两种碱溶液中溶质的物质的量浓度一定相等 B、稀释后,X溶液的碱性比Y溶液的碱性强 C、完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY D、若8<a<10,则X、Y都是弱碱
A、稀释前,两种碱溶液中溶质的物质的量浓度一定相等 B、稀释后,X溶液的碱性比Y溶液的碱性强 C、完全中和X、Y溶液时,消耗同浓度盐酸的体积VX>VY D、若8<a<10,则X、Y都是弱碱二、【选修3做】
-
15. 关于氢键,下列说法正确是( )A、所有含氢元素的化合物中都存在氢键,氢键比范德华力强 B、H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 C、氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 D、分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内16. 下列描述中正确的是( )A、CS2为V形的极性分子 B、ClO3﹣的空间构型为平面三角形 C、SiF4和SO32﹣的中心原子均为sp2杂化 D、SF6中有6对相同的成键电子对
三、【选修5做】
-
17. 化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用色素.苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如图:

下列关于“苏丹红4号”说法正确的是( )
A、不能发生加成反应 B、属于甲苯同系物 C、属于芳香烃 D、能发生水解反应18. 由溴乙烷制取乙二醇,依次发生反应的类型是( )A、消去、加成、水解 B、取代、加成、水解 C、水解、消去、加成 D、消去、水解、取代四、非选择题
-
19. 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
 (1)、打开K2 , 闭合K1 , 若所盛溶液为CuSO4溶液:则A为极,B极的电极反应式为 .
(1)、打开K2 , 闭合K1 , 若所盛溶液为CuSO4溶液:则A为极,B极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向极(填A、B)
(2)、打开K1 , 闭合K2 , 若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 . 总反应化学方程式是 .
②反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL,将溶液充分混合,溶液的pH约为 . 若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 .
(3)、如要用电解方法精炼粗铜,打开K1 , 闭合K2 , 电解液选用CuSO4溶液,则A电极的材料应换成是 , 反应一段时间后电解质溶液中Cu2+浓度(填“增大”、“减小”、“不变”).20. 请回答下列问题.(1)、水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol•L﹣1的NaOH溶液中,由水电离出的c(H+)=mol•L﹣1 , KW(25℃) KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)、电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.化学式
电离平衡常数(25℃)
HCN
K=4.9×10﹣10
CH3COOH
K=1.8×10﹣5
H2CO3
K1=4.3×10﹣7、K2=5.6×10﹣11
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO﹣)(填“>”、“<”或“=”).
21. 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:(1)、准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .(2)、取10.00mL待测液,用量取.(3)、用0.2010mol•L﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.(4)、根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)滴定次数
待测液体积
(mL)
标准盐酸体积(mL)
滴定前读数(mL)
滴定后读数(mL)
第一次
10.00
0.50
20.40
第二次
10.00
0.10
22.10
第三次
10.00
4.00
24.10
(5)、以下操作会造成测量结果偏高的是①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.
五、【选修3做】
-
22. 氮、磷、砷为同主族元素,回答下列问题:(1)、基态As原子的核外电子排布式为 .(2)、镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是(用元素符号表示)(3)、As4O6的分子结构如图1所示,其中As原子的杂化方式为 , 1mol As406含有σ键的物质的量为 .
 (4)、该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是 .
(4)、该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是 . A、稳定性 B、沸点 C、R﹣H键能 D、分子间作用力(5)、AsH3的沸点(﹣62.5℃)比NH3的沸点(﹣33.5℃)低,原因是(6)、NH4+中的H﹣N﹣H的键角比 NH3中的H﹣N﹣H的键角(填”大”或”小”),原因是23. 写出下列化合物的名称或结构简式:
A、稳定性 B、沸点 C、R﹣H键能 D、分子间作用力(5)、AsH3的沸点(﹣62.5℃)比NH3的沸点(﹣33.5℃)低,原因是(6)、NH4+中的H﹣N﹣H的键角比 NH3中的H﹣N﹣H的键角(填”大”或”小”),原因是23. 写出下列化合物的名称或结构简式:①
 的名称为 .
的名称为 . ②
 的名称为 . 24. 已知有机化合物X中各元素的质量分数分别为C﹣﹣﹣60%,H﹣﹣﹣13.3%,O﹣﹣﹣26.7%.
的名称为 . 24. 已知有机化合物X中各元素的质量分数分别为C﹣﹣﹣60%,H﹣﹣﹣13.3%,O﹣﹣﹣26.7%.请填空:
(1)、有机物X的实验式为 . 若0.1molX在足量氧气中充分燃烧需消耗氧气10.08L(标准状况),则X的分子式为 .(2)、实验表明:X能与金属钠反应产生H2 . X分子的核磁共振氢谱中有4个吸收峰,且面积之比为3:2:2:1,则X分子中含有的官能团的名称为 , X的结构简式为 .(3)、X有两种同分异构体Y和Z,其中Y能与金属钠反应产生H2 , 而Z不能.则Y、Z的结构简式分别为、 .