2016-2017学年福建省龙岩市六校联考高一下学期期中化学试卷
试卷更新日期:2017-06-28 类型:期中考试
一、选择题.
-
1. 下列说法中,正确的是( )A、二氧化硅可用来制造太阳能电池 B、需要加热才能进行的反应一定是吸热反应 C、铜的金属性比铝弱,可以用铜罐贮运浓硝酸 D、NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中2. 下列物质中属于共价化合物的是( )A、NH4Cl B、CuSO4 C、CO2 D、Br23. 下列反应过程中的能量变化与如图相符的是( )
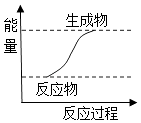 A、金属钠和水反应 B、生石灰变成熟石灰的反应 C、Al和Fe2O3的铝热反应 D、CaCO3受热分解4. 医学研究证明,用放射性 I治疗肿瘤可收到一定疗效.下列有关 I叙述正确的是( )A、 I是碘的一种同素异形体 B、 I是一种新发现的元素 C、 I位于元素周期表中第4周期Ⅳ族 D、 I核内的中子数与核外电子数之差为295. 下列反应中,不属于可逆反应的是( )A、Cl2与水反应 B、水电解生成H2 和H2在O2中燃烧生成水的相互转化过程 C、工业合成氨 D、氨气与水反应6. 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
A、金属钠和水反应 B、生石灰变成熟石灰的反应 C、Al和Fe2O3的铝热反应 D、CaCO3受热分解4. 医学研究证明,用放射性 I治疗肿瘤可收到一定疗效.下列有关 I叙述正确的是( )A、 I是碘的一种同素异形体 B、 I是一种新发现的元素 C、 I位于元素周期表中第4周期Ⅳ族 D、 I核内的中子数与核外电子数之差为295. 下列反应中,不属于可逆反应的是( )A、Cl2与水反应 B、水电解生成H2 和H2在O2中燃烧生成水的相互转化过程 C、工业合成氨 D、氨气与水反应6. 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )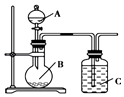 A、稀H2SO4 B、Na2SO4溶液 C、Na2CO3溶液 D、Na2SiO3溶液7. X2﹣离子核外有a个电子,b个中子,则该微粒X原子可表示为( )A、a+b+2a+2 X B、a+b﹣2a﹣2 X C、b﹣2a+2 X D、ba X8. 铷元素(Rb)位于元素周期表中第五周期第ⅠA族,有关Rb及其化合物的性质推测正确的是( )A、Rb与冷水反应比K更剧烈 B、Rb投入CuSO4溶液中可置换出Cu C、Rb与O2反应只有Rb2O产生 D、Rb2CO3难溶于水9. 下列有关说法正确的是( )A、NaOH是只含离子键的离子化合物 B、HCl溶于水没有破坏共价键 C、碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 D、在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成10. 对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )A、升高温度 B、改用50mL2mol/L盐酸 C、改用200mL1mol/L盐酸 D、用等量铁粉代替铁片11. 可逆反应N2+3H2 2NH3 , 在体积不变的密闭容器中反应,达到平衡状态的标志是( )A、单位时间内生成n molN2的同时生成n molNH3 B、N2、H2、NH3的物质的量浓度比值为1:3:2 C、v(N2)=v(NH3) D、单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键12. 下列离子反应方程式正确的是( )A、少量二氧化碳通入“水玻璃”中:CO2+SiO32﹣+H2O═CO32﹣+H2SiO3↓ B、碳酸钙与稀盐酸混合:CO32﹣+2H+═CO2↑+H2O C、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ D、Al2O3溶于NaOH溶液中:Al2O3+2OH﹣═2[Al(OH)4]﹣13. 要将SiO2 固体中Al2O3杂质除去,可用的试剂是( )A、浓氨水 B、NaOH溶液 C、盐酸 D、CO2和水14. 取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )A、稀H2SO4 B、稀盐酸 C、K2SO4固体 D、KNO3固体15. 下列有关叙述能说明非金属元素M比N的非金属性强的是( )A、非金属单质M能从N的化合物中置换出非金属单质N B、在反应中M原子比N原子得到更多电子 C、M的气态氢化物稳定性比N弱 D、M的氧化物对应水化物的酸性比N强16. 已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式:Cu2O+2H+═Cu+Cu2++H2O.现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )A、反应中Cu2O只作氧化剂 B、若有28.8g Cu2O参加反应,则转移电子数为0.2NA C、Cu2O的稳定性比CuO弱 D、如果溶液中出现蓝色,说明CuO已分解17. 将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )
A、稀H2SO4 B、Na2SO4溶液 C、Na2CO3溶液 D、Na2SiO3溶液7. X2﹣离子核外有a个电子,b个中子,则该微粒X原子可表示为( )A、a+b+2a+2 X B、a+b﹣2a﹣2 X C、b﹣2a+2 X D、ba X8. 铷元素(Rb)位于元素周期表中第五周期第ⅠA族,有关Rb及其化合物的性质推测正确的是( )A、Rb与冷水反应比K更剧烈 B、Rb投入CuSO4溶液中可置换出Cu C、Rb与O2反应只有Rb2O产生 D、Rb2CO3难溶于水9. 下列有关说法正确的是( )A、NaOH是只含离子键的离子化合物 B、HCl溶于水没有破坏共价键 C、碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 D、在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成10. 对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )A、升高温度 B、改用50mL2mol/L盐酸 C、改用200mL1mol/L盐酸 D、用等量铁粉代替铁片11. 可逆反应N2+3H2 2NH3 , 在体积不变的密闭容器中反应,达到平衡状态的标志是( )A、单位时间内生成n molN2的同时生成n molNH3 B、N2、H2、NH3的物质的量浓度比值为1:3:2 C、v(N2)=v(NH3) D、单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键12. 下列离子反应方程式正确的是( )A、少量二氧化碳通入“水玻璃”中:CO2+SiO32﹣+H2O═CO32﹣+H2SiO3↓ B、碳酸钙与稀盐酸混合:CO32﹣+2H+═CO2↑+H2O C、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ D、Al2O3溶于NaOH溶液中:Al2O3+2OH﹣═2[Al(OH)4]﹣13. 要将SiO2 固体中Al2O3杂质除去,可用的试剂是( )A、浓氨水 B、NaOH溶液 C、盐酸 D、CO2和水14. 取一定质量的铜片和一定体积的浓硫酸放在烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,若要使铜片继续溶解可向烧瓶中加入( )A、稀H2SO4 B、稀盐酸 C、K2SO4固体 D、KNO3固体15. 下列有关叙述能说明非金属元素M比N的非金属性强的是( )A、非金属单质M能从N的化合物中置换出非金属单质N B、在反应中M原子比N原子得到更多电子 C、M的气态氢化物稳定性比N弱 D、M的氧化物对应水化物的酸性比N强16. 已知CuO高温灼烧生成Cu2O,Cu2O与稀H2SO4反应的离子方程式:Cu2O+2H+═Cu+Cu2++H2O.现将经高温灼烧后的CuO样品投入足量稀硫酸中得到混合溶液,有关说法正确的是( )A、反应中Cu2O只作氧化剂 B、若有28.8g Cu2O参加反应,则转移电子数为0.2NA C、Cu2O的稳定性比CuO弱 D、如果溶液中出现蓝色,说明CuO已分解17. 将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( )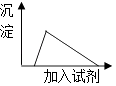 A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图18. 镁铝合金5.1g溶于500mL 1mol/L的盐酸中,向反应后的溶液中加入过量 NaOH溶液,最终生成5.8g白色沉淀.下列有关说法不正确的是( )A、白色沉淀为Mg(OH)2 B、在加入NaOH过程中生成沉淀最多为13.6g C、生成H2体积为5.6L D、刚加NaOH 溶液就有沉淀生成
A、该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存 B、该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存 C、向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图 D、向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图18. 镁铝合金5.1g溶于500mL 1mol/L的盐酸中,向反应后的溶液中加入过量 NaOH溶液,最终生成5.8g白色沉淀.下列有关说法不正确的是( )A、白色沉淀为Mg(OH)2 B、在加入NaOH过程中生成沉淀最多为13.6g C、生成H2体积为5.6L D、刚加NaOH 溶液就有沉淀生成二、填空题
-
19. X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y
Z
R
请回答下列问题:
(1)、写出Y元素的名称: , Q的原子结构示意图;R在周期表中的位置为 .(2)、Q2Z电子式为: , Q2Z2含的化学键类型为: .(3)、R、Z分别形成简单离子的半径大小:(离子符号表示)(4)、Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为: .20. 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)⇌2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题: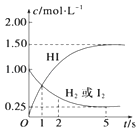 (1)、容器的体积V=L.(2)、反应达到最大限度的时间是 s,该时间内平均反应速率v(HI)= .21. 为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计了如下4组实验.注意:设计实验时,必须控制只有一个变量!
(1)、容器的体积V=L.(2)、反应达到最大限度的时间是 s,该时间内平均反应速率v(HI)= .21. 为了研究外界条件对H2O2分解速率的影响,有同学利用实验室提供的仪器和试剂设计了如下4组实验.注意:设计实验时,必须控制只有一个变量!试剂:4% H2O2溶液,12% H2O2溶液,1mol/LFeCl3溶液
仪器:试管、带刻度的胶头滴管、酒精灯
组别
实验温度 (℃)
H2O2溶液
FeCl3溶液 (1mol/L)
1
30
5mL 4%
1mL
2
60
5mL 4%
1mL
3
30
5mL 12%
4
30
5mL 4%
(1)、甲同学为了研究温度对化学反应速率的影响,应完成实验(填组别).(2)、乙同学进行实验3与实验4,发现气体均缓慢产生,无法说明“浓度改变会影响化学反应速率”,你的改进方法是 .(3)、丙同学进行了实验1与实验4,你认为他想探究的是 . 该方案设计是否严谨?(填是或否),说明理由 .22. 硝酸铝[Al(NO3)3]是一种常用媒染剂.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如图: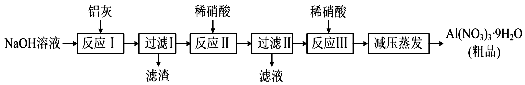 (1)、过滤Ⅰ得到的滤渣主要成分是;(填化学式)(2)、写出反应Ⅰ中生成气体的反应离子方程式:;(3)、在反应Ⅱ中加入稀硝酸存在不足之处是 , 可将加入稀硝酸改为;(4)、温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),其中一种为红棕色,该反应的化学方程式是 .23. 某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究.
(1)、过滤Ⅰ得到的滤渣主要成分是;(填化学式)(2)、写出反应Ⅰ中生成气体的反应离子方程式:;(3)、在反应Ⅱ中加入稀硝酸存在不足之处是 , 可将加入稀硝酸改为;(4)、温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),其中一种为红棕色,该反应的化学方程式是 .23. 某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究.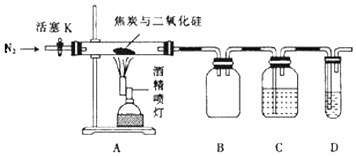
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O═CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊).
(1)、实验的主要步骤如下:①点燃酒精喷灯
②检查装置的气密性
③通入N2一段时间
④向A的硬质玻璃管中装入焦炭(过量)与二氧化硅混合物共m g则正确的操作顺序是 .
(2)、实验时要通入足够长时间的N2 , 其原因是 .(3)、装置D中所盛试剂为 (填序号)A、NaOH溶液 B、Ca(OH)2溶液 C、PdCl2溶液 D、稀H2SO4溶液(4)、若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则A中反应的化学方程式为 . 实验结束后,C装置增重ng,求m g混合物中SiO2的质量分数 .