2017年山东省淄博市高考化学一模试卷
试卷更新日期:2017-06-28 类型:高考模拟
一、选择题
-
1. 化学与生活、社会可持续发展密切相关,下列叙述错误的是( )A、CO2的大量排放会导致酸雨的形成 B、黄河三角洲的形成体现了胶体聚沉的性质 C、推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放 D、轮船上挂锌锭防止铁腐蚀,属于牺牲阳极的阴极保护法2. 设NA为阿伏加德罗常教的值,下列叙述正确的是( )A、18g重水(D2O)所含的电子数为10NA B、常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA C、标准状况下,22.4L CCl4中含有NA个CCl4分子 D、常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA3. 下列叙述正确的是( )A、NH4+、Al3+、Cl﹣、HCO3﹣在溶液中能大量共存 B、H2O2的电子式是:
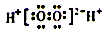 C、AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D、铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示
4. 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )
C、AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D、铁锈是化合物,可用Fe2O3•nH2O(2<n<3)表示
4. 短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,W原子的质子数是其最外层电子数的三倍.下列说法不正确的是( )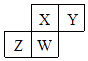 A、元素Y有同素异形体 B、最高价氧化物对应水化物的酸性:X>Z C、简单气态氢化物的热稳定性:Y>Z D、原于半径:W>Z>Y>X5. 下列实验操作和理象、结论均正确且有因果关系的是( )
A、元素Y有同素异形体 B、最高价氧化物对应水化物的酸性:X>Z C、简单气态氢化物的热稳定性:Y>Z D、原于半径:W>Z>Y>X5. 下列实验操作和理象、结论均正确且有因果关系的是( )选项
实验操作和现象
结论
A
向某溶液中滴加CCl4 , 振荡、静置,下层溶液显紫色
原溶液中含有I﹣
B
常温下,0.1mol/LNaHSO3溶液的pH约为5
HSO3﹣的电离程度大于其水解程度
C
相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH
亚硫酸的酸性强于碳酸
D
向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色
稀HNO3将Fe氧化为Fe2+
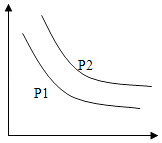
A、A B、B C、C D、D6.可逆反应L(s )+aG(g)⇌bR(g)△H 达到平衡时、温度和压强对该反应的影响如图所示:x轴表示温度,y轴表示平衡混合气中G的体积分数,压强p1>P2 . 下列判断正确的是( )
 A、1+a<b B、△H<0 C、a>b D、增加L的物质的量,可提高G的转化率7. 将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
A、1+a<b B、△H<0 C、a>b D、增加L的物质的量,可提高G的转化率7. 将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )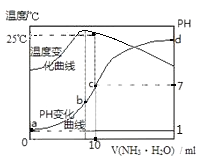 A、n=1.0 B、水的电离程度:b>c>a>d C、c点:c(NH4+)=c(Cl﹣)=1.0mol•L﹣1 D、25℃时,NH4Cl的水解常数(Kh)=(n﹣1)×10﹣7
A、n=1.0 B、水的电离程度:b>c>a>d C、c点:c(NH4+)=c(Cl﹣)=1.0mol•L﹣1 D、25℃时,NH4Cl的水解常数(Kh)=(n﹣1)×10﹣7二、非选择题
-
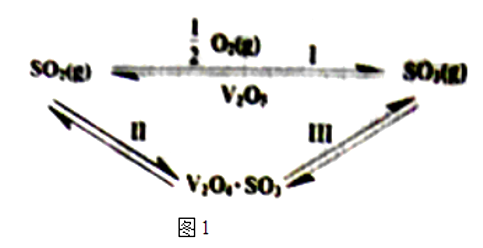
8. 硫酸工业中,作为催化剂的V2O5对反应Ⅰ的催化过程经历了Ⅱ、Ⅲ两个反应阶段,如图1:
 (1)、下列分子中1mol化学键断裂时需要吸收的能量数据如表:
(1)、下列分子中1mol化学键断裂时需要吸收的能量数据如表:化学键
S=O(SO2)
S=O(SO3)
O=O(O2)
能量/kJ
535
472
496
则反应I的△H=kJ/mol.反应Ⅲ的化学方程式为 .
(2)、从废钒催化剂中回收V2O5的过程如图2: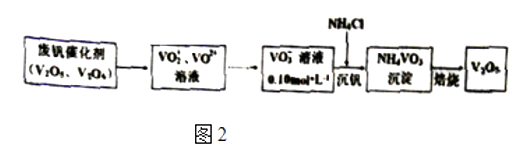
①VO2+离子可由钒同价态的简单阳离子完全水解得到,该水解反应的离子方程式 .
②“沉钒”时为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为[25℃,Ksp(NH4VO3)=1.6×10﹣3 , 溶液体积变化忽略不计].
(3)、采用脱硫脱硝技术,同时吸收SO2和NOx , 获得(NH4)2SO4的稀溶液.①向此溶液稀溶液中再加入少量(NH4)2SO4固体, 将(填“变大”、“不变”或“变小”).
②常温下,0.05mol/L(NH4)2SO4溶液的pH=a,则 =(用含a的代数式表示,NH3•H2O的Kb=1.7×10﹣5)
9. 利用如图装置设计实验,制备SO2并进行探究.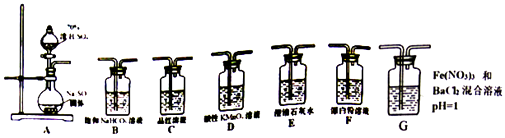 (1)、装置A中反应的化学方程式: .(2)、将A中产生的SO2持续通入装置G中直至过量.
(1)、装置A中反应的化学方程式: .(2)、将A中产生的SO2持续通入装置G中直至过量.①G中有白色沉淀生成,其化学式为 .
②写出反应初始时SO2被氧化的离子方程式: .
(3)、选用A~F中的装置验证H2SO4的酸性强于H2CO3 , 能作为依据的实验现象是: .(4)、要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A .
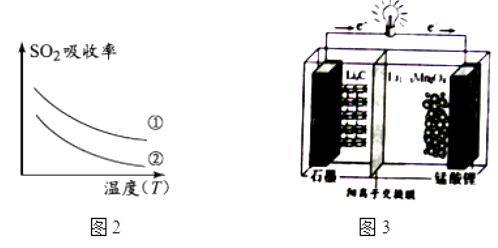
10. 锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1:
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物
Fe(OH)3
Fe(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
3.4
7.7
完全沉淀
3.7
9.6
4.7
9.8
(1)、已知:(图2)表二表二
实验序号
SO2浓度(g•m﹣3)
烟气流速(mL•min﹣1)
①
4.1
55
②
4.1
96
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)、加入试剂X能提高产品纯度,则X可以是(填化学式)(3)、加氨水调溶液pH在5~6之间,目的是 .(4)、锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC LiMnO4+C(x<1)①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
三、【化学--选修3--物质结构与性质】
-
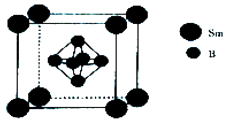
11. 硼及其化合物在工农业生产中应用广泛.(1)、基态硼原子的核外电子排布式为 , 有种不同能量的电子.(2)、BF3溶于水后.在一定条件下可转化为H3O+•[B(OH)F3]﹣ , 该物质中阳离子的空间构型为 , 阴离子的中心原子轨道采用杂化.(3)、与BH4﹣互为等电子休的分子是(写化学式).(4)、EminBF4的熔点为12℃,在常温下为液体,由有机物阳离子[Emin]+和[BF4]﹣构成.该物质的晶体属于晶体.(5)、一种由硼和钐(Sm)形成的晶体的晶胞结构如图所示,已知晶胞常数a=n pm,则晶体的密度为g•cm﹣3(设NA为阿伏加德罗常数的值).
四、【化学--选修5--有机化学基础】
-
12. 双安妥明可用于降低血液中的胆固醇,其结构简式为:
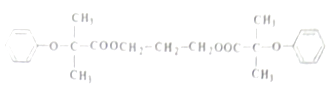
该物质的合成线路如图:
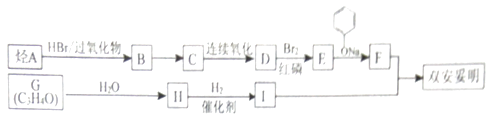
已知:I.RCH2COOH
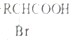
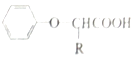
II.RCH═CH2 RCH2CH2Br
III.同温同压下A的密度是H2密度的28倍,且支链有一个甲基;G能发生银镜反应,且1molG能与2molH2发生加成反应.
(1)、双安妥明的分子式为 .(2)、A的结构简式为 .(3)、反应B→C的反应条件是 , G→H的反应类型是 .(4)、反应“F+I→双安妥明”的化学方程式为 .(5)、符合下列3个条件的F的同分异构体有种.条件:①与FeCl3溶液显色;②苯环上只有两个取代基;③1mol该物质最多可与3molNaOH反应.(6)、参照上述合成路线,请设计由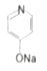 (
(  与苯环性质相似)与
与苯环性质相似)与  合成
合成 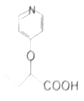 的路线: .
的路线: .
-