2017年安徽省合肥市高考化学一模试卷
试卷更新日期:2017-06-28 类型:高考模拟
一、单选题
-
1. 化学已经渗透到人类生活的方方面面.下列说法正确的是( )A、“青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 B、去皮苹果放在空气中久置变黄与纸张久置变黄原理相似 C、高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” D、酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关2. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、0.1molC2H6O分子中含C﹣H键数目为0.5NA B、1L1mol•L﹣1的NH4Cl溶液中含有NH4+数目为0.1NA C、8.4gNaHCO3和MgCO3混合物中含有阴离子数目为0.1NA D、标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA3. 欲证明一瓶无色液体是纯水,可靠的实验方法是( )A、1.01×105Pa时沸点为100℃ B、测得其pH=7 C、遇钠生成氢气 D、电解时得到H2与O2的体积比为2:14. 下列各组离子在给定条件下一定能大量共存的是( )A、滴加甲基橙显红色的溶液中:Na+、K+、Cl﹣、ClO﹣ B、滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42﹣、Br﹣ C、 =1.0×1012mol/L的溶液中:K+、Na+、NO3﹣、HCO3﹣ D、由水电离的c(H+)=1.0×10﹣13mol/L的溶液中:NH4+、Fe2+、NO3﹣、SO42﹣5. 下列反应的离子方程式表达正确的是( )A、FeCl3溶液中滴加HI解液:2Fe3++2HI═2Fe2++2H++I2 B、1mol•L﹣1NaAlO2溶液和4 mol•L﹣1HCl溶液等体积混合:AlO2-+4H+═Al3++2H2O C、NH4HSO4溶液中滴加少量Ba(OH)2溶液:NH4++H++SO42﹣+Ba2++2OH﹣═BaSO4↓+NH3•H2O+H2O D、Na2S2O3溶液中滴加过量稀H2SO4:3S2O32﹣+2H+═4S↓+2SO42﹣+H2O6. 利用下列实验装置及药品能完成相应实验的是( )A、
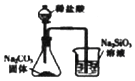 如图用于证明非金属性强弱:Cl>C>S
B、
如图用于证明非金属性强弱:Cl>C>S
B、 如图用于分离I2和NH4Cl
C、
如图用于分离I2和NH4Cl
C、 如图用于测定某NaOH溶液的浓度
D、
如图用于测定某NaOH溶液的浓度
D、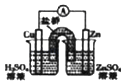 如装置能组成Cu﹣Zn原电池
7. 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )
如装置能组成Cu﹣Zn原电池
7. 下表所列各组物质中,物质之间通过一步反应不能实砚如图所示转化的是( )选项
X
Y
Z
A
Na
NaOH
NaCl
B
Si
SiO2
Na2SiO3
C
Cl2
HClO
NaClO
D
NO
NO2
HNO3
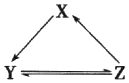 A、A B、B C、C D、D8. 某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )
A、A B、B C、C D、D8. 某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )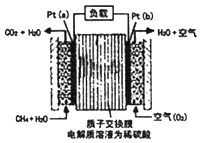 A、电子由a极流出经过负载流向b极 B、电解质溶液中H+移向a极 C、每转移1mole﹣ , 消耗1.6gCH4 D、b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣9. 乙醇与酸性K2Cr2O7溶液混合可发生如下反应:Cr2O72﹣+C2H5OH+H+=Cr3++CH3COOH+H2O(未配平).下列叙述不正确的是( )A、Cr2O72﹣中Cr元素化合价为+6 B、氧化产物为CH3COOH C、K2Cr2O7溶液常用硫酸酸化 D、1mol C2H5OH发生上述反应转移2mole﹣10. 在密闭容器中进行反应:X(g)+2Y(g)⇌2Z(g)△H>0.下图能正确表示该反应有关物理量变化规律的是( )A、
A、电子由a极流出经过负载流向b极 B、电解质溶液中H+移向a极 C、每转移1mole﹣ , 消耗1.6gCH4 D、b极上的电极反应式为:O2+2H2O+4e﹣=4OH﹣9. 乙醇与酸性K2Cr2O7溶液混合可发生如下反应:Cr2O72﹣+C2H5OH+H+=Cr3++CH3COOH+H2O(未配平).下列叙述不正确的是( )A、Cr2O72﹣中Cr元素化合价为+6 B、氧化产物为CH3COOH C、K2Cr2O7溶液常用硫酸酸化 D、1mol C2H5OH发生上述反应转移2mole﹣10. 在密闭容器中进行反应:X(g)+2Y(g)⇌2Z(g)△H>0.下图能正确表示该反应有关物理量变化规律的是( )A、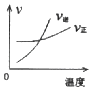 B、
B、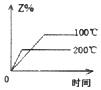 C、
C、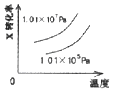 D、
D、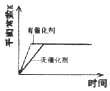 11. 下列实验“操作和现象”与“结论”对应且正确的是( )
11. 下列实验“操作和现象”与“结论”对应且正确的是( )选项
操作和现象
结论
A
将少量溴水加入KI溶液中,充分反应后再加入CCl4 , 振荡,静置,下层液体呈紫色
氧化性:Br2>I2
B
常温下,打磨后的铝片放入HNO3中,无明显现象
常温下,铝不与浓HNO3反应
C
向一定量AgNO3溶液中,先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
用pH计测定NaF溶液和CH3COONa溶液可知:pH(NaF)<pH(CH3COONa)
酸性:HF>CH3COOH
A、A B、B C、C D、D12. 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=﹣lgc(Ag+),pX=﹣lgc(X﹣),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X﹣)的相互关系.下列说法错误的是( )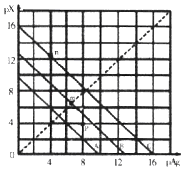 A、A线是AgCl的溶解平衡曲线 B、坐标点p形成的溶液是AgCl的不饱和溶液 C、m点是在水中加入足量的AgBr形成的饱和溶液 D、n点表示由过量的KI与AgNO3反应产生AgI沉淀13. 常温下,向1L0.1mol•L﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
A、A线是AgCl的溶解平衡曲线 B、坐标点p形成的溶液是AgCl的不饱和溶液 C、m点是在水中加入足量的AgBr形成的饱和溶液 D、n点表示由过量的KI与AgNO3反应产生AgI沉淀13. 常温下,向1L0.1mol•L﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )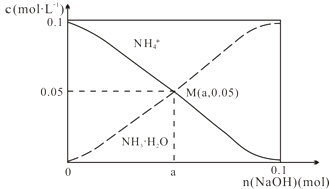 A、M点溶液中水的电离程度比原溶液小 B、在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol C、随着NaOH的加入, 不断增大 D、当n(NaOH)=0.1mol时,c(OH﹣)>c(Cl﹣)﹣c(NH3•H2O)14. amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3﹣的量为( )A、62(a+b)g B、186(a+b)g C、(cV﹣ )mol D、(cV﹣ )mol
A、M点溶液中水的电离程度比原溶液小 B、在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol C、随着NaOH的加入, 不断增大 D、当n(NaOH)=0.1mol时,c(OH﹣)>c(Cl﹣)﹣c(NH3•H2O)14. amolFeS与bmolFeO投入VLcmol/L的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3﹣的量为( )A、62(a+b)g B、186(a+b)g C、(cV﹣ )mol D、(cV﹣ )mol二、解答题
-
15. X、Y、Z、W是原子序数依次增大的短周期主族元素.通常状况下,X与W元素均能形成﹣1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素.X、Z和W的原子最外层电子教之和为20.回答下列问题:(1)、X在兀素周期表中的位置是 .(2)、X和Y元素简单离子的半径较大的是(填离子符号);Z和W元素气态氢化物的稳定性较强的是(填化学式).(3)、Y的氧化物中既含离子键又含共价键的是(用电子式表示).(4)、Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为 .16. 化合物C是某合成路线的中间体,可通过下列(如图)路径合成:
回等下列问题:
 (1)、CH3CH2OH分子中的官能团名称是 .(2)、A与H2反应的反应类型为; A的一氯代物同分异构体数目有种.(3)、写出由B生成C的化学方程式: .17. 亚硝酸钠常用作食品防腐剂.现用如图所示仪器(夹持装置已省略)及药品.探究亚硝酸钠与硫酸的反应及生成气体产物的成分.已知气体液化的温度:NO2:21℃;﹣152℃
(1)、CH3CH2OH分子中的官能团名称是 .(2)、A与H2反应的反应类型为; A的一氯代物同分异构体数目有种.(3)、写出由B生成C的化学方程式: .17. 亚硝酸钠常用作食品防腐剂.现用如图所示仪器(夹持装置已省略)及药品.探究亚硝酸钠与硫酸的反应及生成气体产物的成分.已知气体液化的温度:NO2:21℃;﹣152℃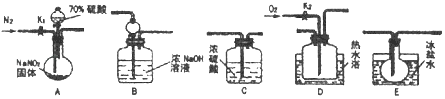
回答下列问题:
(1)、为了检验装置A中生成的气体产物,仪器的连接顺序为(按从左到右连接):A→C→→→ .(2)、组装好仪器后,接下来进行的操作是;实验开始时通入N2的作用是 .(3)、关闭弹簧夹K1 , 打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.确认A中产生的气体中含有NO,依据的现象是;装置E的作用是 .(4)、根据上述实验,写出该反应的化学方程式: . 如果没有装置C,对验证结论造成的影响是 .(5)、实验结束后还需通入N2的作用是;如果向D中通入过量O2 , 则装置B中发生反应的离子方程式为 .18. 铁及其化合物在生产和生活中有着广泛的应用.I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
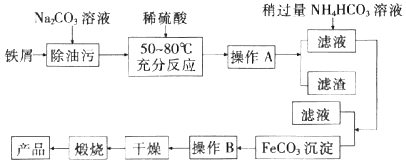
回答下列问题:
(1)、操作A、B的名称分别是、;加入稍过量的NH4HCO3溶液的作用是 .(2)、写出在空气中充分加热煅烧FeCO3的化学方程式: .(3)、II.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质.某同学为测定产品中Fe2O3的含量,进行如下实验:a.称取样品8.00g,加入足量稀H2SO4溶解,并加水稀杯至100mL;
b.量取25.00mL待测溶液于锥形瓶中;
c.用酸化的0.01000mol•L﹣1KMnO4标准液滴定至终点;
d.重复操作b、c2~3次,得出消耗KMnO4溶液体积的平均值为20.00mL.
写出滴定过程中发生反应的离子方程式: .
(4)、确定滴定达到终点的操作及现象为 .(5)、上述样品的质量分数为 .(6)、下列操作会导致样品中Fe2O3的质量分数的测定结果偏低的有 .a.未干燥锥形瓶 b.盛装标准液的滴定管没有用标准液润洗
c.滴定结束时仰视刻度线读数 d.量取待测液的滴定管没有润洗.
19. 氮和硫及其化合物的转化是资源利用和环境保护的重要研究课题.(1)、已知反应I:2SO2(g)+O2(g)⇌2SO3(g),△H=﹣196.6KJ•mol﹣1反应II:2NO(g)+O2(g)⇌2NO2(g),△H=﹣113.0KJ•mol﹣1
则SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热反应方程式为 .
(2)、①若在绝热恒容密闭容器中通入一定量的SO2和O2 , 一定条件下发生反应I,一段时间内,正反应速率随时间变化曲线如图所示,则在a点时,反应(填“达到”或“未达到”)平衡状态;t1~t3时间内,v正先增大后减小的主要原因是 .②若在两个相同绝热恒容密闭容器中分别加入A:2molSO2(g)和1molO2(g);B:2molSO3(g),其它条件相同,发生反应I,达到平衡时,则该反应的平衡常数:AB(填“>”、“=”、“<”).
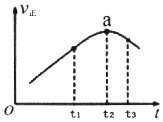 (3)、已知常温下,H2S的电离常数:K1=1.3×10﹣7 , K2=7.1×10﹣15 , Ksp(H2S)=4×10﹣53 , Ksp(Ag2S)=6.3×10﹣50 , Ksp(HgS)=1.6×10﹣52 , 则0.1mol/L H2S溶液的pH约为(取近似整数值);向浓度均为0.001mol•l﹣1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2﹣)为 .(4)、NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术.现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2 , 则原混合气体中NO和NO2的物质的量之比为 .
(3)、已知常温下,H2S的电离常数:K1=1.3×10﹣7 , K2=7.1×10﹣15 , Ksp(H2S)=4×10﹣53 , Ksp(Ag2S)=6.3×10﹣50 , Ksp(HgS)=1.6×10﹣52 , 则0.1mol/L H2S溶液的pH约为(取近似整数值);向浓度均为0.001mol•l﹣1的AgNO3和Hg(NO3)2混合溶液中通入H2S气体,开始生成沉淀的c(S2﹣)为 .(4)、NH3催化还原氮氧物技术(SCR)是目前应用广泛的烟气氮氧化物脱除技术.现有NO、NO2的混合气6L,可用同温同压下7L的NH3恰好使其完全转化为N2 , 则原混合气体中NO和NO2的物质的量之比为 .