江苏省苏州市昆山市2018-2019学年九年级上学期化学期末考试试卷
试卷更新日期:2019-09-27 类型:期末考试
一、单选题
-
1. 成语是中华民族智慧的结晶。下列成语所描述的变化涉及化学变化的是()A、刻舟求剑 B、滴水成冰 C、聚沙成塔 D、百炼成钢2. 豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”、“锌”是指:( )A、单质 B、元素 C、原子 D、分子3. 下列属于物质化学性质的是( )A、导热性 B、延展性 C、氧化性 D、挥发性4. 下列厨房用品中,易溶于水形成溶液的是()A、白砂糖 B、豆奶粉 C、甜面酱 D、花生油5. 实验室制取二氧化碳的操作中,最适合取用块状石灰石的仪器是()A、
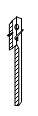 B、
B、 C、
C、 D、
D、 6. 下列物质属于纯净物的是()A、干冰 B、硬铝 C、硬水 D、空气7. 下列物质由离子构成的是()A、铜 B、食盐 C、氯气 D、金刚石8. 氧化铟(In2O3)可用来生产触摸屏,其中铟(In)的化合价为()A、0 B、+l C、+2 D、+39. 科学家用单个分子制戚的“纳米车”能在人工操纵下运输药物分子到病源处释放,杀死癌细胞。下列叙述错误的是( )A、分子是由原子构成的 B、分子之间有间隙 C、分子是肉眼不能够直接看见的 D、分子在人为外力作用下才能运动10. 下列粒子结构示意图中,表示阳离子的是()A、
6. 下列物质属于纯净物的是()A、干冰 B、硬铝 C、硬水 D、空气7. 下列物质由离子构成的是()A、铜 B、食盐 C、氯气 D、金刚石8. 氧化铟(In2O3)可用来生产触摸屏,其中铟(In)的化合价为()A、0 B、+l C、+2 D、+39. 科学家用单个分子制戚的“纳米车”能在人工操纵下运输药物分子到病源处释放,杀死癌细胞。下列叙述错误的是( )A、分子是由原子构成的 B、分子之间有间隙 C、分子是肉眼不能够直接看见的 D、分子在人为外力作用下才能运动10. 下列粒子结构示意图中,表示阳离子的是()A、 B、
B、 C、
C、 D、
D、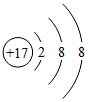 11. 芯片是内含集成电路的硅片,下图是硅元素在元素周期表中的相关信息,下列说法正确的是( )
11. 芯片是内含集成电路的硅片,下图是硅元素在元素周期表中的相关信息,下列说法正确的是( ) A、硅元素属于金属元素 B、硅元素的原子序数为14 C、硅元素的相对原子质量为28.09g D、硅元素是地壳中含量最高的元素12. 如图是检查装置气密性的过程。最终在F处观察到的现象是( )
A、硅元素属于金属元素 B、硅元素的原子序数为14 C、硅元素的相对原子质量为28.09g D、硅元素是地壳中含量最高的元素12. 如图是检查装置气密性的过程。最终在F处观察到的现象是( ) A、甲 B、乙 C、丙 D、丁13. 苏州博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是()A、放于体验区,让观众触摸 B、放在充满氮气的展览柜中 C、定期用清水冲洗,除去灰尘 D、用盐水除去铁剑上的锈斑14. 下列物质的性质与应用对应关系正确的是()A、氦气密度小,可用于填充探空气球 B、石墨质地软,可用作电池电极 C、氢气难溶于水,可用于制盐酸 D、镁粉有金属光泽,可用作照明弹15. 人类的日常生活和工农业生产离不开水,下列说法正确的是()A、天然水经过自然沉降、过滤、吸附,即得纯水 B、用水浇灭着火的纸箱,其原理是移除了可燃物 C、使用加有洗涤剂的水可去除衣服上的油污 D、无法用水鉴别硝酸铵、氢氧化钠两种固体16. 下列实验操作正确的是A、塞紧胶塞
A、甲 B、乙 C、丙 D、丁13. 苏州博物馆藏有一柄古代铁剑,为防止其生锈,下列做法合理的是()A、放于体验区,让观众触摸 B、放在充满氮气的展览柜中 C、定期用清水冲洗,除去灰尘 D、用盐水除去铁剑上的锈斑14. 下列物质的性质与应用对应关系正确的是()A、氦气密度小,可用于填充探空气球 B、石墨质地软,可用作电池电极 C、氢气难溶于水,可用于制盐酸 D、镁粉有金属光泽,可用作照明弹15. 人类的日常生活和工农业生产离不开水,下列说法正确的是()A、天然水经过自然沉降、过滤、吸附,即得纯水 B、用水浇灭着火的纸箱,其原理是移除了可燃物 C、使用加有洗涤剂的水可去除衣服上的油污 D、无法用水鉴别硝酸铵、氢氧化钠两种固体16. 下列实验操作正确的是A、塞紧胶塞 B、贮存氧气
B、贮存氧气  C、过滤
C、过滤  D、吹灭酒精灯
D、吹灭酒精灯  17. 下列关于溶液的说法中正确的是()A、均一稳定的液体都是溶液 B、稀盐酸的溶质是水 C、溶液都有良好的导电性 D、溶液加水稀释前后,溶质的质量不变18. 下列有关比较正确的是()A、人类利用金属的年代先后顺序:铁>铜 B、铁合金中的含碳量:钢>生铁 C、铁在不同溶液中的锈蚀程度:河水>海水 D、氧化物中铁元素的质量19. 考虑到实验的安全、成功等问题,化学实验中常常需要特别关注实验的先后顺序。下列实验的先后顺序关系错误的是()A、点燃甲烷等可燃性气体之前,要先验纯,后点燃 B、实验室制取气体时,要先检查装置的气密性,后加入试剂进行反应 C、用高锰酸钾制取氧气的实验结束时,要先把导气管从水槽中取出,后撤离酒精灯 D、利用CO与氧化铁反应制取铁的实验结束时,要先停止通入CO,后停止加热固体20. 将少量乙醇(C2H5OH)完全溶解于汽油中可作为汽车燃料,简称乙醇汽油。下列说法错误的是()A、乙醇是由9个原子构成的 B、乙醇汽油就是乙醇的汽油溶液 C、静置后乙醇汽油不会出现分层现象 D、使用乙醇汽油可节省石油资源21. 艾华同学在做“二氧化碳熄灭烛火”实验时,他倾倒二氧化碳后上面的烛火先熄灭了(见如图).于是同学们对该实验进行了讨论,其中观点正确的是()
17. 下列关于溶液的说法中正确的是()A、均一稳定的液体都是溶液 B、稀盐酸的溶质是水 C、溶液都有良好的导电性 D、溶液加水稀释前后,溶质的质量不变18. 下列有关比较正确的是()A、人类利用金属的年代先后顺序:铁>铜 B、铁合金中的含碳量:钢>生铁 C、铁在不同溶液中的锈蚀程度:河水>海水 D、氧化物中铁元素的质量19. 考虑到实验的安全、成功等问题,化学实验中常常需要特别关注实验的先后顺序。下列实验的先后顺序关系错误的是()A、点燃甲烷等可燃性气体之前,要先验纯,后点燃 B、实验室制取气体时,要先检查装置的气密性,后加入试剂进行反应 C、用高锰酸钾制取氧气的实验结束时,要先把导气管从水槽中取出,后撤离酒精灯 D、利用CO与氧化铁反应制取铁的实验结束时,要先停止通入CO,后停止加热固体20. 将少量乙醇(C2H5OH)完全溶解于汽油中可作为汽车燃料,简称乙醇汽油。下列说法错误的是()A、乙醇是由9个原子构成的 B、乙醇汽油就是乙醇的汽油溶液 C、静置后乙醇汽油不会出现分层现象 D、使用乙醇汽油可节省石油资源21. 艾华同学在做“二氧化碳熄灭烛火”实验时,他倾倒二氧化碳后上面的烛火先熄灭了(见如图).于是同学们对该实验进行了讨论,其中观点正确的是() A、此实验不能说明CO2密度比空气的大 B、此实验仅能说明CO2不燃烧、不助燃 C、此实验说明CO2密度比空气的小 D、此实验仍能说明CO2不燃烧、不助燃、密度比空气大22. 在一定条件下,下列物质的转化不能一步实现的是()A、Fe→Fe3O4 B、CuSO4→Cu C、CO2→CO D、H2O2→H223. 将mg碳和铜的混合物放置在敞口容器中充分加热,完全反应后剩余固体的质量仍为mg,则原混合物中铜的质量分数为()A、70% B、72.7% C、80% D、84.2%24. 下列除去杂质选用的方法正确的是()A、用燃烧的方法除去CO2气体中少量的CO B、用加热的方法除去NaCl固体中少量的NH4HCO3 C、用过量的稀硫酸除去Fe粉中少量的Zn粉 D、用过量的稀盐酸除去CaCO3固体中少量的CaCl225. 下列说法中符合“1+1=2”的事实的是()A、常温下,1L水和1L酒精混合后液体的总体积为2L B、点燃时,1g硫粉和1g氧气完全反应后生成二氧化硫的质量为2g C、常温下,1g镁粉和1g稀硫酸充分反应后所得溶液的质量为2g D、常温下,1g氢氧化钠稀溶液和1g硫酸铜稀溶液混合后所得溶液的质量为2g
A、此实验不能说明CO2密度比空气的大 B、此实验仅能说明CO2不燃烧、不助燃 C、此实验说明CO2密度比空气的小 D、此实验仍能说明CO2不燃烧、不助燃、密度比空气大22. 在一定条件下,下列物质的转化不能一步实现的是()A、Fe→Fe3O4 B、CuSO4→Cu C、CO2→CO D、H2O2→H223. 将mg碳和铜的混合物放置在敞口容器中充分加热,完全反应后剩余固体的质量仍为mg,则原混合物中铜的质量分数为()A、70% B、72.7% C、80% D、84.2%24. 下列除去杂质选用的方法正确的是()A、用燃烧的方法除去CO2气体中少量的CO B、用加热的方法除去NaCl固体中少量的NH4HCO3 C、用过量的稀硫酸除去Fe粉中少量的Zn粉 D、用过量的稀盐酸除去CaCO3固体中少量的CaCl225. 下列说法中符合“1+1=2”的事实的是()A、常温下,1L水和1L酒精混合后液体的总体积为2L B、点燃时,1g硫粉和1g氧气完全反应后生成二氧化硫的质量为2g C、常温下,1g镁粉和1g稀硫酸充分反应后所得溶液的质量为2g D、常温下,1g氢氧化钠稀溶液和1g硫酸铜稀溶液混合后所得溶液的质量为2g二、实验题
-
26. 利用如图所示装置探究可燃物燃烧的条件。
 (1)、白磷(P4)在空气中的燃烧产物与红磷的燃烧产物相同,写出白磷燃烧的化学方程式:。(2)、对比铜片上白磷燃烧和红磷不燃烧的现象,说明可燃物燃烧的条件之一是。(3)、能说明可燃物燃烧需要与氧气接触的现象是。(4)、烧杯中80℃的热水所起的作用是。(5)、实验完毕将烧杯中的热水慢慢倒出,当白磷刚露出水面便剧烈燃烧起来,其原因。(6)、从以上实验可得到的启示:实验室保存少量白磷的方法是。27. 如图是配制180g溶质质量分数为10%的NaCl溶液的实验操作示意图。
(1)、白磷(P4)在空气中的燃烧产物与红磷的燃烧产物相同,写出白磷燃烧的化学方程式:。(2)、对比铜片上白磷燃烧和红磷不燃烧的现象,说明可燃物燃烧的条件之一是。(3)、能说明可燃物燃烧需要与氧气接触的现象是。(4)、烧杯中80℃的热水所起的作用是。(5)、实验完毕将烧杯中的热水慢慢倒出,当白磷刚露出水面便剧烈燃烧起来,其原因。(6)、从以上实验可得到的启示:实验室保存少量白磷的方法是。27. 如图是配制180g溶质质量分数为10%的NaCl溶液的实验操作示意图。 (1)、正确的操作顺序是(填图中的数字序号)。(2)、请在图中画出即将向天平左侧托盘上加氯化钠固体进行称量时游码(用“
(1)、正确的操作顺序是(填图中的数字序号)。(2)、请在图中画出即将向天平左侧托盘上加氯化钠固体进行称量时游码(用“ ”表示)的位置。
”表示)的位置。  (3)、在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,则接下来的操作应该是。(4)、实验中需要量取水的体积为mL,应选择规格为mL(选填“50”、“100”、“200”或“250”)的量筒来量取水。(5)、溶解时,用玻璃棒搅拌的作用是。(6)、下列操作会导致所配溶液的溶质质量分数偏大的是_____。A、氯化钠固体不纯 B、配制溶液的烧杯事先用少量蒸馏水润洗 C、用量筒量取水时俯视读数 D、把配制好的溶液装入细口瓶时有少量液体洒出
(3)、在称取氯化钠的过程中,观察到指针轻微的偏向分度盘的右侧,则接下来的操作应该是。(4)、实验中需要量取水的体积为mL,应选择规格为mL(选填“50”、“100”、“200”或“250”)的量筒来量取水。(5)、溶解时,用玻璃棒搅拌的作用是。(6)、下列操作会导致所配溶液的溶质质量分数偏大的是_____。A、氯化钠固体不纯 B、配制溶液的烧杯事先用少量蒸馏水润洗 C、用量筒量取水时俯视读数 D、把配制好的溶液装入细口瓶时有少量液体洒出三、科学探究题
-
28. 某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。(1)、I.探究铜锈的组成
(查阅资料)①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按如图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。

(解释与结论)C中反应的化学方程式是。
(2)、依据以上现象分析,铜锈中一定含有的元素:Cu和。(3)、II.探究铜生锈的条件(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号
①
②
③
④
⑤
实验

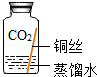



现象
无明显现象
无明显现象
铜丝表面
有绿色物质
无明显现象
无明显现象
(解释与结论)
实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是。
(4)、得出“铜生锈一定与CO2有关”的结论,依据的两个实验是(填编号)。(5)、对比实验②和③,得出的结论是。(6)、为验证猜想,请在图中将实验⑤补充完整。(7)、由上述实验可推知,铜生锈的条件是。(8)、结合上述实验,你对保存铜制品的建议是。29. 过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。(1)、Ⅰ.不稳定性如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为。
 (2)、能用排水法收集氧气的原因是。(3)、已知:常温常压下,氧气的密度为1.33g•L﹣1 . 实验小组称量了10g溶质质量分数为6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为mL(选填“50”、“200”或“250“”)的量筒收集氧气较为合适。(4)、实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如表:
(2)、能用排水法收集氧气的原因是。(3)、已知:常温常压下,氧气的密度为1.33g•L﹣1 . 实验小组称量了10g溶质质量分数为6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为mL(选填“50”、“200”或“250“”)的量筒收集氧气较为合适。(4)、实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如表:实验序号
①
②
③
H2O2溶液的浓度%
30
30
30
H2O2溶液的体积/mL
6
6
6
温度/℃
20
35
55
MnO2的用量/g
0
0
0
反应时间/min
40
40
40
收集O2的体积/mL
0
1.9
7.8
由此得出的结论是。
(5)、Ⅱ.腐蚀性(查阅资料)H2O2溶液有一定的腐蚀性。
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
编号
④
⑤
⑥
实验



一段时间后的现象
无明显变化
溶液变蓝,缓慢产生细小气泡
无明显变化
(解释与结论)
实验④的作用是。
(6)、实验⑤中铜片被腐蚀的反应为Cu+H2O2+H2SO4=CuSO4+ , 请补全该反应的化学方程式。(7)、(反思交流)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是。
四、计算题
-
30. 小明同学利用以下材料自制酸甜可口的汽水。
材料:1瓶(500mL)纯净水、5g蔗糖(C12H22O11)、1.5g小苏打(NaHCO3)、1.5g柠檬酸(C6H8O7)。
制备过程如下图所示:
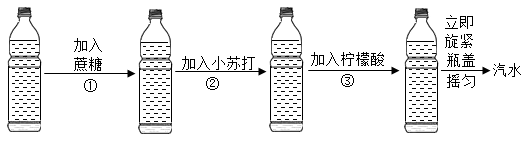
已知:小苏打与柠檬酸发生的反应为3NaHCO3 +C6H8O7=C6H5O7Na3+3H2O+3CO2↑
(1)、NaHCO3由种元素组成,其相对分子质量为。(2)、蔗糖中各元素的质量比为。(3)、柠檬酸中碳元素的质量分数为。(4)、加入柠檬酸后,立即旋紧瓶盖的原因是。(5)、自制汽水的溶质有C6H5O7Na3、CO2、C12H22O11和(填化学式)。五、流程题
-
31. 利用空气制取氮肥的主要流程如图:
 (1)、过程Ⅰ是利用空气中各成分的沸点不同,分离得到氮气,该过程发生的是变化(选填“物理”或“化学”)。(2)、过程Ⅱ中,氮气和氢气反应生成氨气,该反应为反应(填基本反应类型名称)。(3)、过程Ⅳ发生反应的微观示意图如图:
(1)、过程Ⅰ是利用空气中各成分的沸点不同,分离得到氮气,该过程发生的是变化(选填“物理”或“化学”)。(2)、过程Ⅱ中,氮气和氢气反应生成氨气,该反应为反应(填基本反应类型名称)。(3)、过程Ⅳ发生反应的微观示意图如图:
过程Ⅳ发生反应的化学方程式为。
(4)、过程Ⅲ中发生的反应为氨气和氧气在催化剂、加热条件下反应生成一氧化氮气体和另一种氧化物W,该反应的化学方程式为 , 并列式计算当有20.4t氨气参加反应时理论上生成的一氧化氮的质量。
-