河北省唐山市玉田县2018-2019学年高二上学期化学期中考试试卷
试卷更新日期:2019-09-24 类型:期中考试
一、单选题
-
1. 在2A+B 3C+4D反应中,表示该反应速率最快的是( )A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s) C、v(C)=1.2mol/(L·min) D、v(D)=1mol/(L·s)2. 下列反应中,属于吸热反应同时又是氧化还原反应的是( )A、Ba(OH)2·8H2O与NH4Cl反应 B、铝与稀盐酸 C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 D、铝热反应3. 下列措施既能加快工业合成氨的速率,又能增大该反应的反应物转化率的是( )A、缩小容器容积 B、移走 NH3 C、提高反应温度 D、使用催化剂4. 用惰性电极分别电解下列各物质水溶液一小段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是( )A、AgNO3 B、Na2SO4 C、CuCl2 D、KI5. 下图所示各烧杯中均盛有海水,铁在其中被腐蚀最快和被保护最好的分别为( )
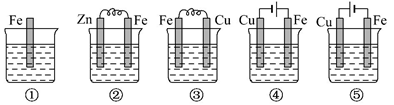 A、①⑤ B、③② C、④⑤ D、④①6. 下列有关电化学装置完全正确的是( )
A、①⑤ B、③② C、④⑤ D、④①6. 下列有关电化学装置完全正确的是( )A
B
C
D

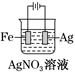

铜的精炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
A、A B、B C、C D、D7. 已知①碳酸钙的分解CaCO3(s)=CaO(s)+CO2(g) ΔH 1 仅在高温下自发进行;②氯酸钾的分解 2KClO3 (s)=2KCl(s)+3O2(g) ΔH 2 , 在任何温度下都自发进行,下面有几组焓变数据,其中可能正确的是( )A、ΔH 1 =+178.32 KJ.mol -1 ΔH 2 =-78.3 kJ·mol -1 B、ΔH 1 =-178.32 kJ.mol -1 ΔH 2 =+78.3 kJ·mol -1 C、ΔH 1 =-178.32 kJ.mol -1 ΔH 2 =-78.3 kJ·mol -1 D、ΔH 1 =+178.32 kJ.mol -1 ΔH 2 =+78.3 kJ·mol -18. 下列说法错误的是()A、钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+ B、钢铁发生吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH- C、破损后的镀锌铁板比镀锡铁板更耐腐蚀 D、用牺牲阳极的阴极保护法保护钢铁,钢铁作原电池的负极9. 可逆反应A(g)+B(g) C(g) +D(g)在反应过程中的能量变化如图所示,下列叙述错误的是( )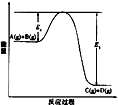 A、该反应是放热反应 B、向反应体系中加入催化剂对反应热无影响 C、向反应体系中加入催化剂,E1减小,E2增大 D、该反应ΔH=-(E2-E1)kJ·mol-110. 反应Ⅰ:CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol-1反应Ⅱ:CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol-1假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( )A、
A、该反应是放热反应 B、向反应体系中加入催化剂对反应热无影响 C、向反应体系中加入催化剂,E1减小,E2增大 D、该反应ΔH=-(E2-E1)kJ·mol-110. 反应Ⅰ:CaSO4(s)+4CO(g) CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol-1反应Ⅱ:CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol-1假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( )A、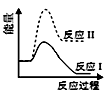 B、
B、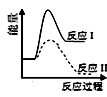 C、
C、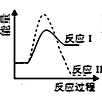 D、
D、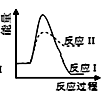 11. 对可逆反应 ,下列图象正确的是()A、
11. 对可逆反应 ,下列图象正确的是()A、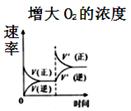 B、
B、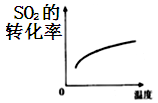 C、
C、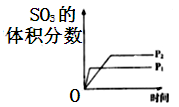 D、
D、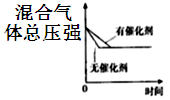 12. 下列事实不能用化学平衡移动原理解释的是( )A、光照新制的氯水时,溶液的pH逐渐减小 B、工业生产中,500℃左右比常温下更有利于合成氨 C、反应 CO +NO2 CO2 +NO △H<0达平衡后,升高温度体系颜色变深 D、增大压强,有利于SO2和O2反应生成SO313. 可逆反应:2A(s) B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )
12. 下列事实不能用化学平衡移动原理解释的是( )A、光照新制的氯水时,溶液的pH逐渐减小 B、工业生产中,500℃左右比常温下更有利于合成氨 C、反应 CO +NO2 CO2 +NO △H<0达平衡后,升高温度体系颜色变深 D、增大压强,有利于SO2和O2反应生成SO313. 可逆反应:2A(s) B(g)+C(g),在一定条件下的刚性密闭容器中,起始时加入一定量的A,能判断反应达到平衡状态的有( )①单位时间内生成2molA的同时生成1molB ②v (B): v (C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变
A、3个 B、4个 C、5个 D、6个14. 某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量( )如下表所示。下列说法正确的是( )X
Y
W
(起始状态)/mol
2
1
0
(平衡状态)/mol
1
0.5
1.5
A、该温度下,此反应的平衡常数表达式是 B、升高温度,若W的体积分数减小,则此反应△H>0 C、增大压强,正、逆反应速率均增大,平衡向正反应方向移动 D、该温度下,再向容器中通入3 mol W,达到平衡时,15. 有关电化学知识的描述正确的是( )A、原电池的两极一定是由活动性不同的两种金属组成 B、一般地说,能自发进行的氧化还原反应可设计成原电池 C、CaO+H2O=Ca(OH)2可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 D、某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液16. 按下图装置实验,若x轴表示流出负极的电子的物质的量,则y轴应表示( )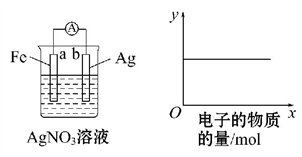
①c(Ag+) ②c(N ) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A、①③ B、③④ C、①②④ D、②17. 将Ba(OH)2、CuCl2、AgNO3、Na2SO4按物质的量比1∶1∶2∶1混合均匀,取一定量该混合物放入水中,充分振荡,插入惰性电极,通电一段时间后,下列说法中正确的是( )①阴极、阳极所得的产物质量比为1∶8 ②通电过程中阳离子向阴极移动 ③阴极电极反应为Ag++e-=Ag ④电解过程中溶液pH升高
A、①② B、②③ C、③④ D、①④18. 已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )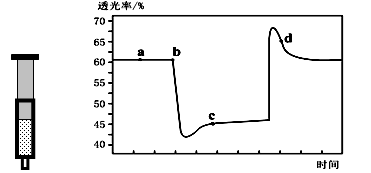 A、b点的操作是拉伸注射器 B、d点:v(正)< v(逆) C、c点与a点相比,c(NO2)增大,c(N2O4)减小 D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)19. 某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置如下图所示,下列有关说法错误的( )
A、b点的操作是拉伸注射器 B、d点:v(正)< v(逆) C、c点与a点相比,c(NO2)增大,c(N2O4)减小 D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)19. 某化工厂用石墨电解Na2CrO4溶液制备Na2Cr2O7的模拟装置如下图所示,下列有关说法错误的( ) A、溶液中OH-由阴极区流向阳极区 B、阳极的电极反应式为2H2O-4e-=O2↑+4H+ C、阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1∶2 D、Na2CrO4转化为Na2Cr2O7的离子方程式为2CrO42-+2H+=Cr2O72-+H2O20. 下列关于测定中和热的说法中正确的是( )A、实验中需要用到的主要玻璃仪器有:两只大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒 B、可以用保温杯来代替烧杯做有关测定中和热的实验 C、在测定中和热的实验中,至少需要测定并记录的温度是2次 D、实验中若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高21. 燃烧a g乙醇(液态),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,a g乙醇与足量钠反应,能生成标准状况下的氢气5.6L,则表示乙醇燃烧热的热化学方程式书写正确的是( )A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -Q kJ/mol B、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q / 2 kJ/mol C、1/2 C2H5OH(l)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -Q kJ/mol D、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -2Q kJ/mol22. 已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
A、溶液中OH-由阴极区流向阳极区 B、阳极的电极反应式为2H2O-4e-=O2↑+4H+ C、阳极区产生的气体与阴极区产生的气体在相同状况下体积之比为1∶2 D、Na2CrO4转化为Na2Cr2O7的离子方程式为2CrO42-+2H+=Cr2O72-+H2O20. 下列关于测定中和热的说法中正确的是( )A、实验中需要用到的主要玻璃仪器有:两只大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒 B、可以用保温杯来代替烧杯做有关测定中和热的实验 C、在测定中和热的实验中,至少需要测定并记录的温度是2次 D、实验中若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高21. 燃烧a g乙醇(液态),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,a g乙醇与足量钠反应,能生成标准状况下的氢气5.6L,则表示乙醇燃烧热的热化学方程式书写正确的是( )A、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -Q kJ/mol B、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = - Q / 2 kJ/mol C、1/2 C2H5OH(l)+3/2O2(g)=CO2(g)+3/2H2O(1) △H = -Q kJ/mol D、C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1) △H = -2Q kJ/mol22. 已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为( )
A、-332 B、-118 C、+350 D、+13023. 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是( )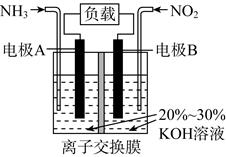 A、电流从左侧电极经过负载后流向右侧电极 B、为使电池持续放电,离子交换膜需选用阴离子交换膜 C、电极A极反应式为2NH3-6e-=N2+6H+ D、当有4.48 L NO2被处理时,转移电子数为0.8NA24. 下列说法或表示方法中正确的是( )A、一定条件下进行的化学反应,只能将化学能转化成光能或热能 B、由C(金刚石)=C(石墨)ΔH=-1.9 kJ·mol-1 ,可知金刚石比石墨稳定 C、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧热的化学方程式为:2H2(g)+ O2(g) =2H2O(l) ΔH = -571.6 kJ·mol-1 D、稀溶液中:H+(aq)+ OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1 ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ
A、电流从左侧电极经过负载后流向右侧电极 B、为使电池持续放电,离子交换膜需选用阴离子交换膜 C、电极A极反应式为2NH3-6e-=N2+6H+ D、当有4.48 L NO2被处理时,转移电子数为0.8NA24. 下列说法或表示方法中正确的是( )A、一定条件下进行的化学反应,只能将化学能转化成光能或热能 B、由C(金刚石)=C(石墨)ΔH=-1.9 kJ·mol-1 ,可知金刚石比石墨稳定 C、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧热的化学方程式为:2H2(g)+ O2(g) =2H2O(l) ΔH = -571.6 kJ·mol-1 D、稀溶液中:H+(aq)+ OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1 ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ二、填空题
-
25. 某密闭容器中发生反应:2A(g)+B(g) 2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。
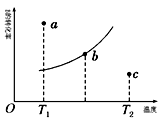
请回答下列问题:
(1)、图中a、b、c三点的化学反应速率(v)由快到慢是。(2)、图中该反应的ΔH0。(3)、图中a、b、c三点,未达到平衡状态且v正>v逆的点是。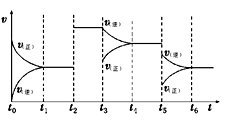
请回答下列问题:
(4)、图中t2时刻改变的外界条件是。(5)、图中从t1 ~ t6 反应物转化率最低的是时刻。26. 请完成下列问题:(1)、Cl2和水蒸气通过灼热的炭层生成HCl和CO2 , 当有1 mol Cl2参与反应时释放145 kJ热量。写出该反应的热化学方程式。(2)、已知CH3OH(l)的燃烧热为238.6 kJ·mol-1 , CH3OH(l)+1/2O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ·mol-1 , 则a238.6(选填“>”、“<”或“=”)。(3)、已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+1/2O2(g)=H2O(l) ΔH2
2As(s)+5/2O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =。
(4)、已知在一定温度下:C(s)+ CO2(g) 2CO(g) 平衡常数K1
C(s)+ H2O(g) CO(g)+ H2(g) 平衡常数 K2
CO(g)+ H2O(g) H2(g)+ CO2(g)平衡常数K3
则K1、K2、K3之间的关系是。
27. 下图为人工肾脏采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2)的原理。请回答下列问题: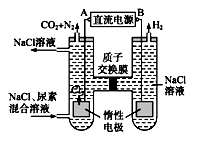 (1)、电源的负极为(选填“A”或“B”)。(2)、阳极室中发生的反应依次为、。(3)、电解结束后,阴极室溶液的pH与电解前相比将(选填“降低”、“增大”或“不变”)。(4)、若两极共收集到标准状况下气体6.72 L,则除去的尿素为__g(忽略气体的溶解)。28. 向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。
(1)、电源的负极为(选填“A”或“B”)。(2)、阳极室中发生的反应依次为、。(3)、电解结束后,阴极室溶液的pH与电解前相比将(选填“降低”、“增大”或“不变”)。(4)、若两极共收集到标准状况下气体6.72 L,则除去的尿素为__g(忽略气体的溶解)。28. 向容积为2 L的密闭容器中加入足量活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g),△H<0,NO和N2的物质的量变化如下表所示。物质的量/mol
T1/℃
T2/℃
0
5 min
10 min
15 min
20 min
25 min
30 min
NO
2.0
1.16
0.80
0.80
0.50
0.40
0.40
N2
0
0.42
0.60
0.60
0.75
0.80
0.80
请回答下列问题:
(1)、0-5 min内,以CO2表示的该反应速率v(CO2)= , 该条件下的平衡常数K=。(2)、第15 min后,温度调整到T2 , 数据变化如上表所示,则T1T2(填“>”、“<”或“=” )。(3)、若30 min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则该可逆反应最终达平衡时NO的转化率α=。三、实验题
-
29. 某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:
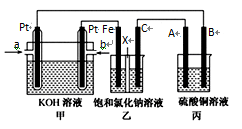 (1)、从 a口通入的气体为。(2)、B电极的电极材料是。(3)、写出甲中通甲烷一极的电极反应式: 。(4)、写出乙中发生的总反应的离子方程式为。
(1)、从 a口通入的气体为。(2)、B电极的电极材料是。(3)、写出甲中通甲烷一极的电极反应式: 。(4)、写出乙中发生的总反应的离子方程式为。四、综合题
-
30. H2O2是中学化学中一种重要的物质。请回答下列问题:(1)、Ⅰ.一定条件下,烧杯中H2O2溶液发生分解反应放出气体的体积和时间的关系如图所示:
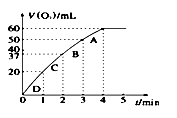
则由D到A过程中,随着反应的进行反应速率逐渐(选填 “加快”或“减慢”),其变化的原因是。
(2)、Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。定性分析:图甲可通过观察定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是。
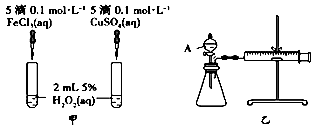 (3)、定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 , 实验中需要测量的数据是。
(3)、定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 , 实验中需要测量的数据是。
-