初中化学人教版九年级上学期 第五单元课题1 质量守恒定律
试卷更新日期:2019-09-19 类型:同步测试
一、基础巩固
-
1. 在加热条件下,铜能与稀硝酸发生反应:3Cu+8HNO3(稀) 3Cu(NO3)2+2X↑+4H2O,则X的化学式为()A、N2O B、NO C、NO2 D、N2O5
-
2. mg硫在足量的氧气中完全燃烧,生成二氧化硫的质量()A、小于mg B、大于mg C、等于mg D、无法判断
-
3. 质量为5g的Mg、Zn的混合物与一定质量的稀硫酸恰好完全反应,经测定反应后的溶液质量增加了4.8g,将反应后的溶液蒸发水分,得到的固体混合物的质量为()A、14.6g B、18.4g C、19.6g D、25g
-
4. 下列关于N2 + O2 2NO的说法中,正确的是( )A、反应后原子种类减少 B、表示氮气加氧气等于一氧化氮 C、参加反应的氮气与氧气的分子个数比为1∶1 D、参加反应的氧气与生成的一氧化氮的质量比为16∶15
-
5. 下列实验能够直接用于验证质量守恒定律的是( )A、
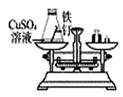 B、
B、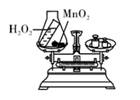 C、
C、 D、
D、
-
6. 黄河是中华民族的母亲河,而素有黄河之肾之称的黄河甘南湿地日趋萎缩,生态环境恶化加剧。(1)、2月2日是世界湿地日,今年世界湿地日的口号是“携手保护湿地,应对气候变化”。湿地的物种资源丰富,分布着大量的植物群落,可以缓解温室效应。湿地缓解温室效应主要是通过光合作用实现的,其过程可以表示为:
 淀粉组成中一定含有元素,可能含有元素。 (2)、“湿地水体富营养化”是保护湿地面临的一个重大难题,引起湿地水体污染的原因可能有(答出一条即可)。
淀粉组成中一定含有元素,可能含有元素。 (2)、“湿地水体富营养化”是保护湿地面临的一个重大难题,引起湿地水体污染的原因可能有(答出一条即可)。 -
7. 2.2g某物质在氧气中完全燃烧,生成6.6g二氧化碳和3.6g水(无其他生成物),则该物质中一定含有元素.(列式计算)各原子的个数比 .
-
8. 半水煤气的主要成分是H2、CO、CO2、N2和水蒸气。工业上用半水煤气合成氨(NH3)的过程如下所示。
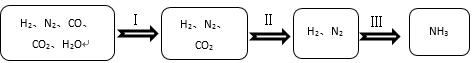 (1)、过程Ⅰ中,发生反应的化学方程式为CO + H2O H2+ , 请补全该反应。(2)、过程Ⅲ合成氨(NH3)的过程中,氮元素化合价发生的变化是。
(1)、过程Ⅰ中,发生反应的化学方程式为CO + H2O H2+ , 请补全该反应。(2)、过程Ⅲ合成氨(NH3)的过程中,氮元素化合价发生的变化是。
二、强化提升
-
9. 实验室加热一定质量的高锰酸钾制取氧气,随着反应的进行,试管内固体的质量逐渐减少。如图中的点表示的含义错误的是( )
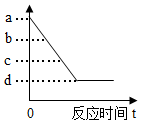 A、a点表示高锰酸钾的质量 B、b点表示高锰酸钾、锰酸钾和二氧化锰混合物的质量 C、c点表示生成二氧化锰的质量 D、d点表示高锰酸钾完全分解了
A、a点表示高锰酸钾的质量 B、b点表示高锰酸钾、锰酸钾和二氧化锰混合物的质量 C、c点表示生成二氧化锰的质量 D、d点表示高锰酸钾完全分解了 -
10. 一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如下表所示。下列有关说法中错误的是()
物质
甲
乙
丙
丁
反应前的质量/g
30
20
10
15
反应后的质量/g
x
y
0
10
A、参加反应的丙与丁的质量比为2:1 B、 C、当 时,该反应一定是化合反应 D、x的取值范围: -
11. 下图所示是某反应前后的微观示意图,“
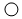 ”和“
”和“  ”表示两种不同的原子,据图分析下列说法正确的是()
”表示两种不同的原子,据图分析下列说法正确的是()  A、该反应是分解反应 B、反应前后分子和原子的种类都发生改变 C、该反应可能为2H2+O2 2H2O D、该反应的生成物为两种
A、该反应是分解反应 B、反应前后分子和原子的种类都发生改变 C、该反应可能为2H2+O2 2H2O D、该反应的生成物为两种 -
12. 在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量变化情况如图所示,下列说法正确的是()
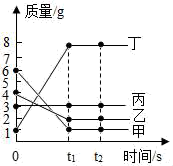
 A、该反应类型为复分解反应 B、丙可能是水 C、生成丁的质量8g D、参加反应的甲、乙质量比为3:2
A、该反应类型为复分解反应 B、丙可能是水 C、生成丁的质量8g D、参加反应的甲、乙质量比为3:2 -
13. 高温条件下,14.4g某种铁的氧化物恰好与5.6g一氧化碳完全反应,则该氧化物中铁元素与氧元素的质量比为()A、18:7 B、7:2 C、7:3 D、21:8
-
14. 质量守恒定律是帮助我们认识化学反应实质的重要理论,在化学反应aA+bB=cC+dD中,下列说法正确的是()A、化学计量数a和b之和一定等于c与d之和 B、A和B相对分子质量之和一定等于C和D的相对分子质量之和 C、反应物A和B的质量比一定等于生成物C和D的质量比 D、若取xgA和xgB反应,生成C和D的质量总和不一定等于2xg
-
15. 天然气的主要成分完全燃烧的化学方程式为;4.6g某纯净物X在O2中完全燃烧,生成8.8gCO2和5.4gH2O,则X中氧元素的质量为。
-
16. 如图所示是测定白磷燃烧前后质量变化和测定空气组成的实验,试回答下列问题:
 (1)、白磷燃烧时的现象 , 反应的化学方程式为 .(2)、左盘上的锥形瓶在白磷点燃后为什么要塞紧瓶口? .(3)、点燃后,若瓶塞未塞紧,待燃烧完毕后再塞紧,天平的指针将会(填“偏左”“偏右”或“居中”)(4)、反应完毕后,冷却至室温,将锥形瓶倒置于水槽中,取下瓶塞,则进入瓶中的水占锥形体积的 .
(1)、白磷燃烧时的现象 , 反应的化学方程式为 .(2)、左盘上的锥形瓶在白磷点燃后为什么要塞紧瓶口? .(3)、点燃后,若瓶塞未塞紧,待燃烧完毕后再塞紧,天平的指针将会(填“偏左”“偏右”或“居中”)(4)、反应完毕后,冷却至室温,将锥形瓶倒置于水槽中,取下瓶塞,则进入瓶中的水占锥形体积的 .
三、真题演练
-
17. 银器发暗是因为形成了黑色的Ag2S。欲使银器变亮,可先用洗衣粉洗去表面油污,再把它和铝片放入碳酸钠溶液中共煮,至银器恢复银白色时,取出银器,用水洗净即可。发生反应的化学方程式为:2Al+3Ag2S+6H2O 6Ag+2Al(OH)3+3X↑,X的化学式是()A、H2S B、SO2 C、SO3 D、O2
-
18. 在一个密闭容器中,有甲、乙、丙、丁、戊五种物质,在一定条件下发生反应,测得反应前后各物质的质量变化量如图所示(图中正数表示物质质量的增加量,负数表示物质质量的减少是,0表示物质质量不变),下列说法正确的是()
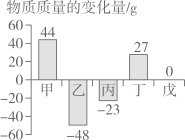 A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27
A、该反应一定属于置换反应 B、戊一定是该反应的催化剂 C、参加反应的乙、丙的质量比一定为48:23 D、该反应中甲、丁的相对分子质量之比一定为44:27 -
19. 在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法错误的是()
物质
a
b
c
d
反应前的质量/g
40
5
16
15
反应后的质量/g
X
5
30
26
A、b可能是催化剂 B、X的值等于15 C、该反应是分解反应 D、参加反应的c与d的质量比为15:13 -
20. 氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如图。下列说法正确的是()
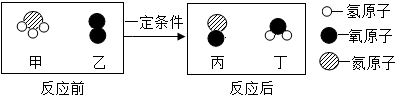 A、生成的丙与丁的分子个数比为2:3 B、乙的相对分子质量为32g C、反应前后分子的个数不变 D、反应过程中共涉及三种氧化物
A、生成的丙与丁的分子个数比为2:3 B、乙的相对分子质量为32g C、反应前后分子的个数不变 D、反应过程中共涉及三种氧化物
