山东省临沂市罗庄区2018-2019学年高二上学期化学1月月考试卷
试卷更新日期:2019-09-11 类型:月考试卷
一、单选题
-
1. 下列叙述正确的是( )A、Kw随温度、浓度的改变而改变 B、Ksp小的难溶电解质其溶解度一定小 C、若某吸热反应能自发进行,则该反应为熵增反应 D、改变条件,使平衡移动,该反应的平衡常数一定改变2. 下列实验操作或对实验事实的叙述正确的是( )A、用湿润的pH试纸测定稀盐酸的pH B、配制FeSO4溶液时,需加入少量铁粉和稀硫酸 C、用碱式滴定管量取 20.00 mL 0.1 mol·L-1 KMnO4溶液 D、用带有玻璃塞的试剂瓶储存Na2CO3溶液3. 室温下,对于0.10mol·L-1的氨水,下列判断正确的是( )A、其溶液的pH=13 B、用HNO3溶液完全中和后,溶液不显中性 C、加水稀释后,溶液中c(NH4+)·c(OH-)变大 D、与AlCl3溶液发生反应的离子方程式为Al3++3OH-==Al(OH)34. 下列有关电化学的叙述正确的是( )
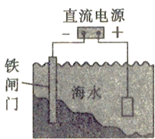 A、镀锌的铁皮镀层破损后,铁更容易腐蚀 B、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 C、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率增大 D、如图对海水中的铁闸门进行电化学防护的方法是牺牲阳极的阴极保护法5. 下列叙述正确的是( )A、稀醋酸中加入少量醋酸钠能促进醋酸的电离 B、SO2、NH3的水溶液均导电,但SO2、NH3均为非电解质 C、0.1 mo1/ L氨水加水稀释后,溶液中所有离子的浓度都减小 D、分别中和等体积、浓度均为0.1 mo1/ L的盐酸和次氯酸溶液,消耗NaOH的物质的量相同,所得溶液的pH也相同6. 如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )
A、镀锌的铁皮镀层破损后,铁更容易腐蚀 B、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 C、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,产生气泡的速率增大 D、如图对海水中的铁闸门进行电化学防护的方法是牺牲阳极的阴极保护法5. 下列叙述正确的是( )A、稀醋酸中加入少量醋酸钠能促进醋酸的电离 B、SO2、NH3的水溶液均导电,但SO2、NH3均为非电解质 C、0.1 mo1/ L氨水加水稀释后,溶液中所有离子的浓度都减小 D、分别中和等体积、浓度均为0.1 mo1/ L的盐酸和次氯酸溶液,消耗NaOH的物质的量相同,所得溶液的pH也相同6. 如图X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味气体放出,符合这一情况的是( )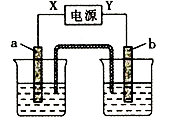
a电极
b电极
X电极
电解质溶液
A
Fe
石墨
正极
稀硫酸
B
Zn
Cu
负极
CuSO4溶液
C
石墨
Pt
负极
AgNO3溶液
D
Pt
Cu
正极
CuCl2溶液
A、A B、B C、C D、D7. 下列说法正确的是( )A、0.1molAgCl和0.1 molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) B、常温下,向饱和CaCO3溶液中加入Na2CO3粉末,CaCO3的溶解度不变 C、25 ℃时,Ksp[ Mg(OH)2 ]=5.61 × 10-12、Ksp(MgF2)=7.12 ×10-11 , 该温度下饱和 Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+) 大 D、常温下Ksp(Ag2SO4)=1. 4× 10-5 , 向10mL 0.1mol/L的Na2SO4溶液中加入10 mL0.1 mol/L的AgNO3溶液,有白色沉淀生成8. 已知1 L Al(NO3)3和Cu(NO3)2的混合溶液中c(NO3-)=0.7mol/L,用石墨作电极电解该混合溶液,当通电一段时回后,两极均有气体生成(电解前后溶液的体积变化忽略不计)。下列说法正确的是( )A、电解后溶液的pH增大 B、电解过程中在阴极附近有沉淀生成 C、原混合溶液中c(Al3+)=0.7mol/L D、电解后溶液中仍有Cu2+9. 常温时,有关稀氨水、铵盐溶液的叙述正确的是( )A、已知0 .10 mo1/ L氨水的电离度为1.32%,该溶液的pH=12 B、向含有NaOH和NH3·H2O的溶液中加入稀盐酸,溶液呈中性时c(Na+)=c(Cl-) C、向10 mL0.1 mo1/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将增大 D、浓度均为0.1 mol/L的下列溶液①NH4HSO4②NH4Al(SO4)2③NH4Cl④(NH4)2SO4中c(NH4+)的大小关系为①>②>④>③10. 下面有关电化学的图示,完全正确的是( )A、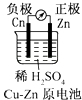 B、
B、 C、
C、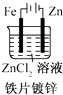 D、
D、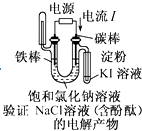 11. 常温下,下列各组离子在指定溶液中因发生氧化还原反应而不能大量共存的是( )A、1.0 mol·L-l的KNO3溶液:H+、Fe2+、Cl-、SO42- B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- C、pH =12的溶液:K+、Na+、CH3COO-、Br- D、与铝反应产生大量氢气的溶液:NH4+、K+、SO42-、CO32-12. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是( )
11. 常温下,下列各组离子在指定溶液中因发生氧化还原反应而不能大量共存的是( )A、1.0 mol·L-l的KNO3溶液:H+、Fe2+、Cl-、SO42- B、甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- C、pH =12的溶液:K+、Na+、CH3COO-、Br- D、与铝反应产生大量氢气的溶液:NH4+、K+、SO42-、CO32-12. 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是( )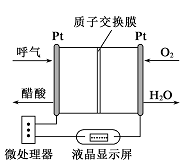 A、O2所在的铂电极处发生氧化反应 B、H+透过质子交换膜流向呼气所在的铂电极 C、电路中流过2mol电子时,消耗标准状况下11.2LO2 D、该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+13. 下列说法正确的是( )A、pH=5的H2S溶液中,c(H+)=c(HS-) =1×10-5 mol/L B、纯银器表面在空气中因发生电化学腐蚀而渐渐变暗 C、在新制氯水中加入氯化钠固体,水的电离平衡不移动 D、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合c(Na+ )<c(CH3COO-)14. 双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是( )A、电解池的阳极生成双氧水,阴极生成臭氧 B、电解池中H+移向阴极 C、产生臭氧的电极反应式为3H2O+6e-=O3+6H+ D、产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+15. 两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述正确的是( )
A、O2所在的铂电极处发生氧化反应 B、H+透过质子交换膜流向呼气所在的铂电极 C、电路中流过2mol电子时,消耗标准状况下11.2LO2 D、该电池的负极反应式为:CH3CH2OH+3H2O-12e-=2CO2+12H+13. 下列说法正确的是( )A、pH=5的H2S溶液中,c(H+)=c(HS-) =1×10-5 mol/L B、纯银器表面在空气中因发生电化学腐蚀而渐渐变暗 C、在新制氯水中加入氯化钠固体,水的电离平衡不移动 D、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合c(Na+ )<c(CH3COO-)14. 双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2 O3+3H2O2。下列有关说法正确的是( )A、电解池的阳极生成双氧水,阴极生成臭氧 B、电解池中H+移向阴极 C、产生臭氧的电极反应式为3H2O+6e-=O3+6H+ D、产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+15. 两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述正确的是( )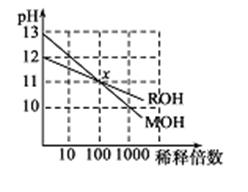 A、MOH是一种弱碱 B、在x点,((M+)=c(R+) C、稀释前,c(MOH)=l0c(ROH) D、稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍16. 常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
A、MOH是一种弱碱 B、在x点,((M+)=c(R+) C、稀释前,c(MOH)=l0c(ROH) D、稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍16. 常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是( )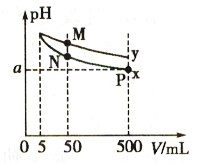 A、a>9 B、稀释后的溶液耗酸量相等 C、曲线y表示NaOH溶液的变化 D、N、P、M点对应的溶液中水的电离程度依次增大17. 有关下列四个常用电化学装置的叙述中,正确的是( )
A、a>9 B、稀释后的溶液耗酸量相等 C、曲线y表示NaOH溶液的变化 D、N、P、M点对应的溶液中水的电离程度依次增大17. 有关下列四个常用电化学装置的叙述中,正确的是( )
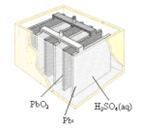
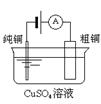
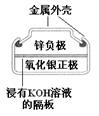
图Ⅰ 碱性锌锰电池
图Ⅱ 铅蓄电池
图Ⅲ 电解精炼铜
图Ⅳ 银锌纽扣电池
A、图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂 B、图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变 C、图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 D、图IV所示电池工作过程中,Ag2O是氧化剂18. 下表中实验操作、现象与结论对应关系正确的是( )选项
实验操作
实验现象
结论
A
以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液
溶液由红色变为浅红色便立刻读数
测得氢氧化钠溶液的浓度偏大
B
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体
有白色沉淀生成,溶液红色变浅
证明纯碱溶液呈碱性是由CO32-水解引起的
C
室温下分别测定NaClO溶液、CH3COONa溶液的pH
前者大
酸性:HClO>CH3COOH
D
NaHCO3溶液中滴入酚酞
溶液变红
弱酸的酸式盐溶液均呈碱性
A、A B、B C、C D、D二、填空题
-
19. 常温下.有浓度均为0.1 mol·L-l的下列4种溶液:①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7
Ka2=5.6×10-11
Ka=1.7×10-5
(1)、这4种溶液pH由大到小的顺序是(填序号)。(2)、④的水解平衡常数Kh= 。(3)、若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③ ④(填“>”、“<"、“=”)(4)、向NaCN溶液中通入少量CO2 , 则发生反应的离子方程式为:。三、计算题
-
20. 电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:(1)、t℃时,纯水中c(H+)=1×10-6 mol·L-1 , 该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为 mol·L-1。(2)、25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)= mol·L-1 , a b(填“﹥”、“﹤”或“=”)。(3)、工业上采取用氨水除去SO2 , 已知25 ℃,NH3• H2O的Kb=1.8×10-5 , H2SO3的 Ka1=1.3 × 10一2 , Ka2=6.2 × 10一8。若氨水的浓度为2.0 mo1/ L,溶液中的c(OH-)= mo1/ L;将SO2通入该氨水中,当c(OH-)降至2.0 × 10一6mo1/ L时,溶液中的 =。(4)、将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液③40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和 ④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是(用字母表示)。
四、综合题
-
21. 电化学知识在物质制备领域的应用前景看好。
 (1)、从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:
(1)、从环境保护的角度看,制备一种新型多功能水处理剂 高铁酸钠(Na2FeO4)较好的方法为电解法,其装置如图①所示:①电解过程中阳极的电极反应式为;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗ClO-的物质的量为mol;
(2)、电解Na2SO4溶液生产H2SO4和烧碱的装置如图③所示(已知:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过),其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2。则丁为;电解一段时间,当产生0.1 mo1气体甲时,通过离子交换膜f的离子的质量为g。(3)、用0.1032 mol/L的NaOH溶液滴定未知浓度的稀盐酸,实验数据如下表:实验序号
消耗NaOH溶液的体积/mL
待测稀盐酸的体积/mL
1
28.84
25.00
2
27.83
25.00
3
27.85
25.00
根据表格计算c(HCl)=。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将 (填“偏大”、“偏小”或“不影响”)。
五、工业流程
-
22. 锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
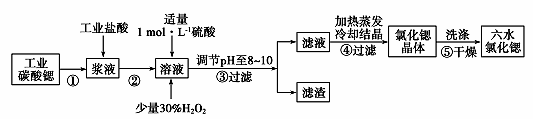
请回答:
(1)、常温下,氯化锶溶液pH7(填“大于”、“等于”或“小于”);(2)、步骤③所得滤渣的主要成分是(填化学式),调节溶液pH至8~10,宜选用的试剂为 。A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)、步骤⑤中,洗涤氯化锶晶体最好选用____。A、水 B、稀硫酸 C、氢氧化钠溶液 D、氯化锶饱和溶液(4)、工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。A、50~60℃ B、70~80℃ C、80~100℃ D、100℃以上(5)、若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 。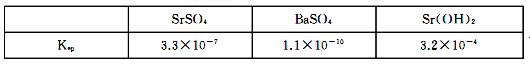
-
-
-