江苏省扬州市2018-2019学年高二下学期化学期末考试试卷
试卷更新日期:2019-09-05 类型:期末考试
一、单选题
-
1. 新能源的开发利用是人类社会可持续发展的必然选择。下列不属于新能源开发利用的是( )




A.风力发电
B.锂电池供电
C.水力发电
D.太阳能供暖
A、A B、B C、C D、D2. Cu2(OH)2CO3是孔雀石的主要成分。Cu2(OH)2CO3属于( )A、酸 B、碱 C、盐 D、氧化物3. 8235Br标记的溴化铵作为示踪剂用于监测沿海污染。该原子的中子数是( )A、47 B、35 C、117 D、824. 下列化学用语表示正确的是( )A、乙烯的结构简式:C2H4 B、氯离子的结构示意图: C、MgF2的电子式:
C、MgF2的电子式:  D、氯化钠在水中电离:NaCl Na+ + Cl-
5. 常温下,下列物质可以用铁制容器盛装的是( )A、浓盐酸 B、浓硫酸 C、硫酸铜溶液 D、硝酸银溶液溶液6. 下列气体可用图所示装置收集的是( )
D、氯化钠在水中电离:NaCl Na+ + Cl-
5. 常温下,下列物质可以用铁制容器盛装的是( )A、浓盐酸 B、浓硫酸 C、硫酸铜溶液 D、硝酸银溶液溶液6. 下列气体可用图所示装置收集的是( ) A、H2 B、N2 C、NO D、Cl27. 下列物质属于离子化合物的是( )A、CH4 B、H2SO4 C、SO2 D、NaF8. 下列常见物质的俗名与化学式对应正确的是( )A、苏打 —— Na2CO3 B、生石灰 —— Ca(OH)2 C、胆矾 —— CuSO4 D、生石膏 —— CaCO39. 合成氨工业发生反应:N2 + 3H2 2NH3 ,下列措施不属于加快反应速率的是( )A、温度控制在500℃ B、铁触媒作为催化剂 C、压强控制在20MPa ~ 50MPa D、混合气体中分离出液态氨10. 下列实验方法或操作正确的是( )A、氨气制备
A、H2 B、N2 C、NO D、Cl27. 下列物质属于离子化合物的是( )A、CH4 B、H2SO4 C、SO2 D、NaF8. 下列常见物质的俗名与化学式对应正确的是( )A、苏打 —— Na2CO3 B、生石灰 —— Ca(OH)2 C、胆矾 —— CuSO4 D、生石膏 —— CaCO39. 合成氨工业发生反应:N2 + 3H2 2NH3 ,下列措施不属于加快反应速率的是( )A、温度控制在500℃ B、铁触媒作为催化剂 C、压强控制在20MPa ~ 50MPa D、混合气体中分离出液态氨10. 下列实验方法或操作正确的是( )A、氨气制备 B、喷泉实验
B、喷泉实验  C、氨气吸收
C、氨气吸收  D、分离乙醇和乙酸
D、分离乙醇和乙酸 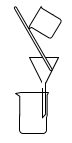 11. 在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )A、NO3- B、HCO3- C、Mg2+ D、Cu2+12. 下列关于油脂的说法错误的是( )A、属于酯类 B、难溶于水 C、属于高分子化合物 D、能发生水解反应13. 中国古代用炉甘石炼锌,主要反应为:2C + ZnCO3 Zn + 3CO,该反应属于( )A、化合反应 B、置换反应 C、分解反应 D、复分解反应14. 下列变化属于物理变化的是( )A、海水晒盐 B、煤的干馏 C、湿法炼铜 D、高炉炼铁15. 下列说法正确的是( )A、Na2O可用作供氧剂 B、聚氯乙烯可作为食品保鲜膜 C、铝热反应可用于焊接铁轨 D、铝槽车可用于稀硝酸的贮运16. 下列有机反应属于取代反应的是( )A、
11. 在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )A、NO3- B、HCO3- C、Mg2+ D、Cu2+12. 下列关于油脂的说法错误的是( )A、属于酯类 B、难溶于水 C、属于高分子化合物 D、能发生水解反应13. 中国古代用炉甘石炼锌,主要反应为:2C + ZnCO3 Zn + 3CO,该反应属于( )A、化合反应 B、置换反应 C、分解反应 D、复分解反应14. 下列变化属于物理变化的是( )A、海水晒盐 B、煤的干馏 C、湿法炼铜 D、高炉炼铁15. 下列说法正确的是( )A、Na2O可用作供氧剂 B、聚氯乙烯可作为食品保鲜膜 C、铝热反应可用于焊接铁轨 D、铝槽车可用于稀硝酸的贮运16. 下列有机反应属于取代反应的是( )A、 B、CH2=CH2 + HCl
B、CH2=CH2 + HCl  CH3CH2Cl
C、2CH3CHO + O2 2CH3COOH
D、CH3CH2OH CH2=CH2↑ + H2O
17. 下列选项描述的过程能实现化学能转化为电能的是( )
CH3CH2Cl
C、2CH3CHO + O2 2CH3COOH
D、CH3CH2OH CH2=CH2↑ + H2O
17. 下列选项描述的过程能实现化学能转化为电能的是( )



A.蜡烛燃烧
B.光合作用
C.手机电池工作
D.太阳能板充电
A、A B、B C、C D、D18. ClO2是目前国际上公认的高效、广谱、快速安全的杀菌剂。工业制ClO2的化学反应为2NaClO3 + SO2 + H2SO4=2ClO2 + 2NaHSO4。下列有关该反应的说法正确的是( )A、SO2是氧化剂 B、NaClO3被氧化 C、SO2发生了还原反应 D、NaClO3得到电子19. 下列实验方案能达到目的的是( )A、用乙醇作萃取剂萃取溴水中的溴 B、用燃烧法除去CO2中混有的少量CO C、用焰色反应鉴别Na2SO4溶液和NaCl溶液 D、用加热法除去Na2CO3固体中的少量NaHCO320. 下列反应的离子方程式书写正确的是( )A、氯气与碘化钾溶液反应:Cl2 + I- = Cl- + I2 B、醋酸除去水垢:2H+ + CaCO3 = Ca2+ + CO2↑ + H2O C、铜和浓硝酸反应:Cu + 4H+ + 2NO = Cu2+ + 2NO2↑ + 2H2O
D、二氧化锰与浓盐酸反应:MnO2 + 4H+ + 4Cl- Mn2+ + 2Cl2↑ + 2H2O
21. 如图为发光二极管连接柠檬电池装置,下列说法正确的是( )
= Cu2+ + 2NO2↑ + 2H2O
D、二氧化锰与浓盐酸反应:MnO2 + 4H+ + 4Cl- Mn2+ + 2Cl2↑ + 2H2O
21. 如图为发光二极管连接柠檬电池装置,下列说法正确的是( ) A、铁环作为柠檬电池的正极 B、电子由发光二极管经导线流向Fe环 C、负极的电极反应为:Fe-2 e-=Fe2+ D、可将柠檬替换成盛装酒精溶液的装置22. 短周期元素X、Y、Z、W原子序数依次增大。X与W同主族,且X最外层电子数是内层电子数的2倍。Y是ⅤA族元素,Z是地壳中含量最高的金属元素。下列叙述正确的是( )A、原子半径:Z > Y > X B、W的氧化物能与某些酸反应 C、元素Y形成的氧化物只有一种 D、X的简单气态氢化物的热稳定性比W的弱23. 硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:
A、铁环作为柠檬电池的正极 B、电子由发光二极管经导线流向Fe环 C、负极的电极反应为:Fe-2 e-=Fe2+ D、可将柠檬替换成盛装酒精溶液的装置22. 短周期元素X、Y、Z、W原子序数依次增大。X与W同主族,且X最外层电子数是内层电子数的2倍。Y是ⅤA族元素,Z是地壳中含量最高的金属元素。下列叙述正确的是( )A、原子半径:Z > Y > X B、W的氧化物能与某些酸反应 C、元素Y形成的氧化物只有一种 D、X的简单气态氢化物的热稳定性比W的弱23. 硝酸工业尾气中的氮氧化合物NOx(NO、NO2、N2O4)常用的处理方法有以下两种:①碱液(Na2CO3或NaOH溶液)吸收法。用Na2CO3溶液吸收反应原理如下:
NO + NO2 + Na2CO3 = 2NaNO2 + CO2;2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
②氨的催化氧化法,反应原理是:NOx + NH3 N2 + H2O
现将标准状况下2.016 L氮氧化合物NOx 通入50 mL 1.0 mol·L-1的Na2CO3溶液,恰好反应完全,且测得反应后溶液中n(NO2-)∶n(NO3-) = 4∶1,下列说法正确的是( )
A、混合气体中V(N2O4) = 0.336 L B、混合气体中n(NO)∶n(NO2) = 1∶5 C、NOx能够完全被Na2CO3溶液吸收,则x ≤ 1.5 D、如采用氨的催化氧化法处理,理论消耗n(NH3) = mol二、综合题
-
24. A.《化学与生活》(1)、为减轻大气污染、遏制火灾隐患,今年扬州市区全面禁燃烟花爆竹。据市环境监测中心提供的数据显示,春节禁放期间,AQI(空气质量指数)改善明显,空气质量明显优于去年同期。
①“禁止燃放烟花爆竹”的标识是。

②AQI评价的主要污染物为PM2.5、、二氧化硫、二氧化氮、臭氧、一氧化碳。
③扬州市2月6日至2月11日空气质量如表,结合表判断扬州空气质量等级达优的有天。
AQI
0~50
51~100
101~150
151~200
空气质量等级
优
良
轻微污染
轻度污染

④燃放烟花爆竹时不仅会造成噪音污染,而且会释放出大量的有毒有害气体,如SO2、NO2等,产生空气污染。SO2和NO2可以在一定条件下反应生成NO和另一种氧化物,造成二次空气污染。写出该反应的化学方程式。
(2)、“蒌蒿满地芦芽短,正是河豚欲上时”是扬州春天真实的写照。①蒌蒿清香、鲜美,脆嫩爽口,含有丰富的维生素C、维生素A、钙、铁等。其中属于人体所需微量元素的是(填元素符号)。
②蒌蒿中含有的维生素A属于维生素(填“水溶性”或“脂溶性”)。
③河豚肉质鲜美,蛋白质丰富。蛋白质在人体内水解的最终产物是。
(3)、2018年10月,世界上最长的跨海大桥—港珠澳大桥正式开通,创造多项世界之最。
①港珠澳大桥采用了世界首创深插式钢圆筒快速成岛技术。深埋在海水中的钢圆筒易发生腐蚀,下列保护钢圆筒的措施不合理的是(填字母)
a.采用铜质扣件固定保护
b.使用抗腐蚀性强的合金
c.在钢管表面喷镀环氧乙烷树脂镀层
②港珠澳大桥使用了世界最大尺寸高阻尼橡胶隔震支座。为使橡胶性能更好,天然橡胶需要处理以增强其机械性能。
③世界首创主动止水的海底沉管隧道使用的超级抗裂钢筋混凝土属于(填字母)。
a.金属材料 b.有机高分子材料 c.复合材料
④港珠澳大桥全线夜景照明全部采用LED光源。LED光源与传统光源比较,其优点有。(写一种)
⑤港珠澳大桥钢结构混凝土预制件吊装采用超高分子质量聚乙烯(UHMWPE)纤维,是目前世界上强度最高的纤维。请写出由乙烯合成聚乙烯的化学方程式:。
(4)、根据分子中所含官能团可预测有机化合物的性质。① 测定某有机物的相对分子质量,常用的方法是(填字母)。
a.质谱法 b.燃烧法 c.核磁共振氢谱法
② 下列有机物中核磁共振氢谱只有1个峰的是(填字母)。
a.甲苯 b.新戊烷 c.乙醚
③ 1mol下列物质完全燃烧时,消耗5mol O2的是(填字母)。
a.乙炔 b.丁烷 c.乙酸乙酯
(5)、咖啡酸具有止血、镇咳、祛痰等疗效,其结构为:
①咖啡酸分子中的含氧官能团的名称为、。
②有关咖啡酸性质的叙述错误的是。
a.在浓硫酸、加热条件下能发生消去反应
b.既能和浓溴水发生加成反应也能发生取代反应
c.能与酸性高锰酸钾溶液反应
d.1 mol 咖啡酸在一定条件下最多能与4 mol H2发生加成反应
(6)、四苯基乙烯(TFE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TFE的一种合成路线(部分试剂及反应条件省略):
①A的结构简式为。
②A B的反应类型为反应;E F的反应类型为反应。
③生成D的化学方程式为。
三、推断题
-
25. 有关物质的转化关系如下图所示(反应条件已略去)。已知:A为紫红色金属,B是强酸,E能使品红溶液褪色,F是海水的主要成分,H是一种难溶于水的白色固体,摩尔质量为99.5 g·mol-1 , I溶液呈黄色,工业上可作为印刷电路板蚀刻液。

请回答下列问题:
(1)、H的化学式为。(2)、F的电子式为。(3)、写出反应①的化学方程式。(4)、写出反应③的离子方程式。四、工业流程
-
26. 某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:

已知:①反应Ⅰ在三颈烧瓶中发生,装置如图所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图;
③Na2SO3·7H2O 和Na2SO3的溶解度曲线如图。
 (1)、为提高Na2SO3产率,反应Ⅰ应控制pH在左右。(2)、反应Ⅱ所得滤液的主要成分是和Na2SO3。(3)、将操作Ⅰ后所得的Na2SO3溶液(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。(4)、可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4 , 发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)(5)、滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是。
(1)、为提高Na2SO3产率,反应Ⅰ应控制pH在左右。(2)、反应Ⅱ所得滤液的主要成分是和Na2SO3。(3)、将操作Ⅰ后所得的Na2SO3溶液(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。(4)、可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4 , 发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)(5)、滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是。
-
-